《Cell》杂志-阻断天然免疫或可治疗渐冻症—STING抑制剂新用途
《Cell》 阻断天然免疫或可治疗“渐冻症”
—STING抑制剂可以改善神经退行性症状
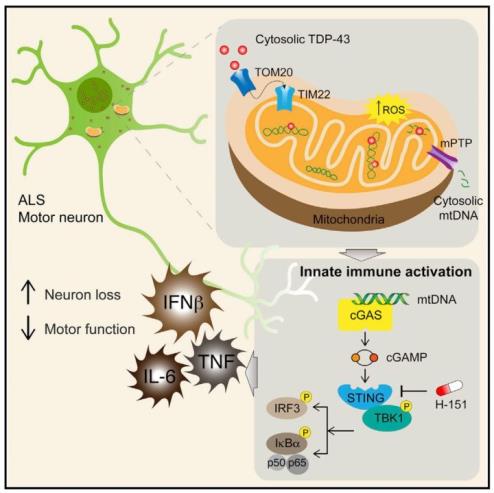
肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS),即我们常说的“渐冻症”,是一种影响运动神经元的神经退行性疾病,已故的著名物理学家霍金(1942-2018)就是一名渐冻症患者。在4%的家族性ALS患者中存在TDP-43突变【1】,尽管TDP-43是一个定位与细胞核的DNA/RNA结合蛋白,但在于几乎所有散发性ALS患者的神经元中都存在TDP-43在细胞质中的累积【2】。因此,TDP-43在细胞质中的累积也成为ALS的重要标志之一,这一特征与ALS患者的神经炎症性细胞因子表征相关联,主要表现为NF-kB和I型干扰素信号通路的升高【3,4】。近日,来自墨尔本大学的Seth L. Masters教授实验室在Cell杂志上发表题为TDP-43 Triggers Mitochondrial DNA Release via mPTP to Activate cGAS/STING in ALS的研究论文,阐释了TDP-43通过在线粒体的累积,诱导线粒体DNA向细胞质释放,并进一步激活cGAS/STING信号通路,引起NF-κB和I型干扰素信号通路的升高。相反,使用STING抑制剂H-151处理可以抵消炎症并改善神经退行性症状。

TDP-43突变诱导神经细胞炎症反应的具体机制并不十分清楚,为了确定TDP-43突变是否通过细胞内在的感应DNA或者RNA的天然免疫信号通路激活炎症反应,作者首先分别在敲除MAVS(感应RNA)、PKR(感应RNA)、cGAS(感应DNA)、STING(感应DNA)的MEFs中过表达野生型TDP-43及ALS突变(Q331K),发现敲除cGAS和STING能够完全阻断由TDP-43 Q331K突变诱导的炎性因子表达。
同样,STING抑制剂H-151和cGAS抑制剂RU.521也能够达到类似效果。更为重要的是,在由ALS患者来源的iPSC诱导分化而成的运动神经元中,STING和cGAS抑制剂能够完全阻断炎症信号通路。cGAS是细胞内DNA的感受器,通过结合细胞内游离的DNA,催化生成cGAMP,cGAMP再结合到STING,激活TBK1及下游信号通路。在ALS患者的脑脊液和上述iPSC诱导分化的运动神经元裂解液中,cGAMP水平都比正常人的高。以上结果一致证明,TDP-43突变是通过cGAS/STING信号通路诱导神经炎症的发生。
作为天然免疫的重要组成部分,cGAS/STING主要负责感受侵入细胞的外源性DNA(如细菌DNA),同时也负责感受来源一细胞自身的DNA(如核DNA和线粒体DNA),为确定TDP-43是通过核DNA还是线粒体DNA来激活cGAS/STING信号通路,作者通过cGAS-IP结合PCR的方法,确定了TDP-43突变主要引起线粒体DNA与cGAS的结合,而在去线粒体DNA的r0细胞中,TDP-43 Q331K突变不能再诱导炎症(INFB1和TNF的表达)。
那么,TDP-43如何促进线粒体DNA的释放呢?线粒体是一个双层细胞器,外膜具有较高通透性,与之相对地,线粒体内膜的通透性较差。通常,线粒体DNA的释放主要通过线粒体通透性转位孔(mPTP)实现,因此,作者进一步验证TDP-43 Q331K突变是否也是通过诱导mPTP开放实现线粒体DNA的释放。通过使用mPTP抑制剂CsA,作者发现抑制mPTP可以有效地阻断TDP-43 Q331K突变引起的线粒体DNA释放。同样地,敲除mPTP组分蛋白Ppid也能达到类似的效果。
那么,在TDP-43突变的ALS小鼠模型中,是否也存在类似的cGAS/STING信号通路激活?并且,阻断cGAS/STING信号通路能否改善神经退行性症状呢?通过对ALS模型小鼠Prp-TDP-43Tg/+(过表达人TDP-43 A315T突变)进行分析,作者发现,该模型小鼠中,脑内、脊髓内及血清内的cGAMP水平均比对照小鼠高。
通过构建Prp-TDP-43Tg/+;Sting-/-小鼠,作者发现,敲除Sting以后:1)小鼠发病时间没有显著区别;2)小鼠存活显著改善;3)小鼠的滚筒平衡实验(rotarod)结果显著改善;4)小鼠步态实验(gait)结果显著改善;5)大脑和脊髓的炎性因子转录水平得到改善;6)大脑皮层V神经元密度得到恢复。最后,作者通过STING抑制剂H-151对ALS模型小鼠Prp-TDP-43Tg/+进行处理,达到了与Sting敲除类似的结论。以上结果表明,通过敲除Sting或者抑制剂阻断STING信号通路,均能够有效改善ALS模型小鼠的炎症信号,恢复神经元数目和功能,并恢复小鼠运动功能。
本研究为TDP-43突变诱导神经炎症提供了完整的机制阐述,通过对iPSC分化的运动神经细胞、ALS模型小鼠及ALS患者样品进行系统分析发现,TDP-43通过诱导mPTP开放,释放线粒体DNA,以激活cGAS/STINF信号通路,诱导TNF及I型干扰素信号的激活,最终引起神经细胞炎症和运动神经功能症状。为使用SITNG抑制剂对ALS患者进行干预提供了理论和实验基础。
原文链接https://doi.org/10.1016/j.cell.2020.09.020
参考文献
1. Sreedharan, J., et al. (2008). TDP-43 mutations in familial and sporadicamyotrophic lateral sclerosis. Science 319,1668–1672.
2. Johnson, B.S., et al. (2009). TDP-43 is intrinsically aggregation-prone,and amyotrophic lateral sclerosis-linked mutations accelerate aggregation andincrease toxicity. J. Biol. Chem. 284, 20329–20339.
3. Zhao, W., et al. (2015). TDP-43 activates microglia through NF-kB andNLRP3 inflammasome. Exp. Neurol. 273, 24–35.
4. Wang, R., et al. (2011). Activation of interferon signaling pathways inspinal cord astrocytes from an ALS mouse model. Glia 59, 946–958.
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29








