Nature综述-单细胞RNA测序揭秘神经元网络连接的时间控制机制
Nature综述-单细胞RNA测序揭秘神经元网络连接的时间控制机制
【高光亮点】
1、通过计算时间动态分数和细胞类型变化分数,对不同RNA的功能进行了验证和推测。
2、利用RNA干扰和GAL4-UAS系统,揭示了神经元相互连接的时控机制。
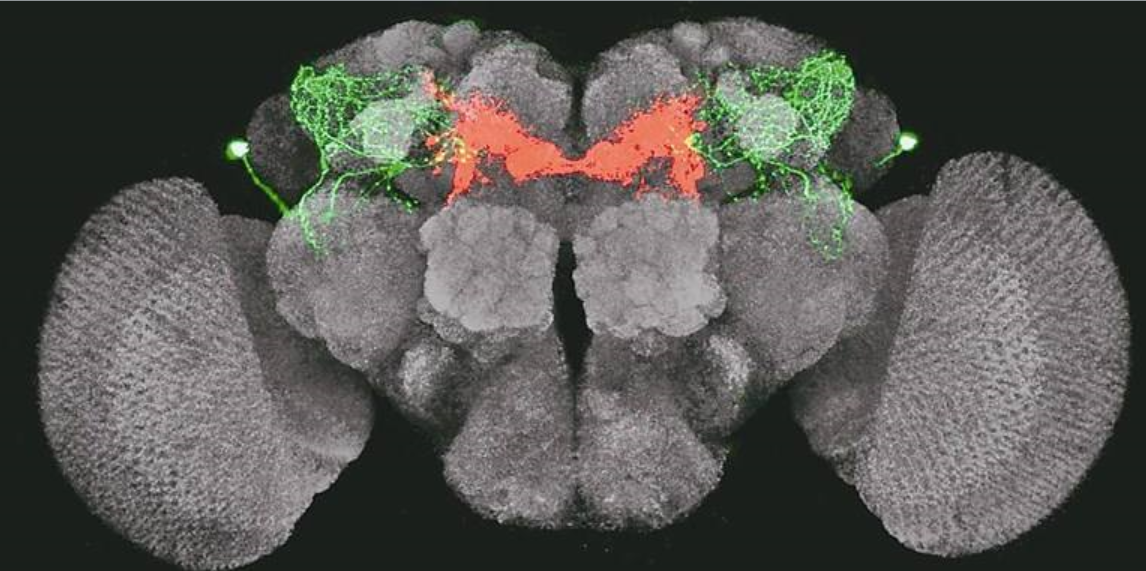
个体的行为取决于脑内的神经环路,而环路之间神经元的相互连接又受到免疫球蛋白、钙粘附素家族等细胞表面蛋白的影响。先前一些报道已经部分揭示了神经元特异性连接的机制,然而研究人员对如何在恰当的时间发生神经元间的相互连接这一问题仍不清楚。蜕皮激素相关通路作为昆虫发育的主要时间调节系统,在幼虫蜕皮和变态过程中发挥重要作用。因此加州大学洛杉矶分校S. Lawrence Zipursky等人利用果蝇模型研究蜕皮激素及其下游转录因子在视神经元的靶向识别和突触发生过程中的调节作用。其研究结果发表在名为《A global timing mechanism regulates cell-type-specific wiring programmes》的文章中。

在先前的研究中,作者利用单细胞RNA测序获得了果蝇视叶*神经元的转录组数据。该数据集包含97种细胞类型,并且作者在蛹形成后的24-96小时内采集了不同时间点的数据共7次。计算数据集内不同类型RNA的时间动态分数和细胞类型变化分数(图1a),前者得分越高表示对应基因表达量随时间波动越大,后者得分越高说明对应基因表达的细胞特异性越强。研究统计发现,大部分基因的时间动态性和细胞类型特异性与先前报道相一致。例如以核糖体蛋白编码基因(RpL36, 图1a左下坐标系)为代表的管家基因,在两个维度上得分都很低,说明其在各类细胞中均有表达且表达量不随时间变化。
*视叶:昆虫前脑的侧叶,为视觉的神经中心。
一些具有高细胞类型特异性和低时间动态性的转录因子(例如erm,图1a左上坐标系),主要在确定和维持神经元类型中发挥作用。而具有高时间动态性的核受体转录因子(如Hr3, Hr4 和ftz-f1,图1a左上坐标系粉色),在视觉系统神经元内的表达时间和顺序与蜕皮激素的波动有关(图1b)。尽管上述转录因子在所有神经元内均有表达,但已有研究表明在某些情况下它们能够调节细胞类型特异性。此外,编码细胞表面蛋白及其类似物的“连接基因”(wiring genes,如beat-IIIc,右上坐标系)在两个维度上得分均较高。目前已有研究报道了调控”连接基因”细胞类型特异性的转录因子,但调控它们时间动态性的因素仍然未知。因此作者猜想蜕皮激素相关通路通过调控“连接基因”的时间动态性和细胞类型特异性,影响果蝇视神经元的突触发生过程。
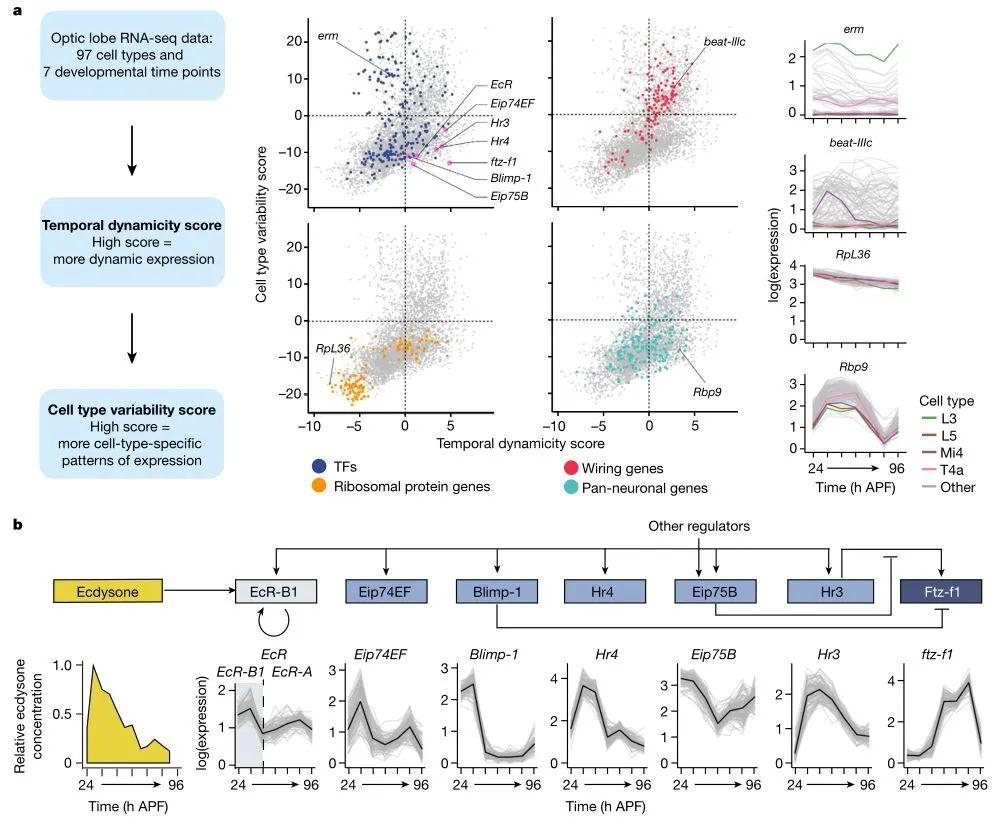
图1 具有时间动态性的“连接基因”和蜕皮激素通路转录因子
为了验证上述猜想,作者利用GAL4-UAS系统*促使果蝇脑内神经元特异性表达EcRDN基因*。由于后者编码的蛋白不能与配体相结合,因此可以通过比较WT型与EcRDN型果蝇视神经元的差异推断蜕皮激素的功能。观察不同神经元的形态学变化,发现沉默EcR基因使多种视神经元的轴突、树突分支发育不良(图2b-d)。
*GAL4-UAS系统:存在于酵母中的基因表达调控系统。有研究者使GAL4在果蝇的特定组织中表达,发现GAL4能特异性激活与UAS相连接的下游基因的转录。因此该系统后来被用于在组织或细胞中进行RNA干扰(RNAi)或插入dorminant-negative组件造成基因沉默或使或基因表达量降低。
*文中EcR指蜕皮激素受体,EcRDN代表插入dorminant-negative组件后使EcR基因沉默。
接着,作者研究了蜕皮激素通路对薄板*上L5神经元的突触发生的作用。在蛹的发育过程中L5神经元轴突末端会延伸到髓质(Medulla)的M5区域,然后在M1形成分支,随后这些分支从M1延伸到M2层(图2f)。在髓质上沉默L5神经元的EcR基因不会影响对M5的定位,但会抑制在M1和M2中形成分支(图2g)。此外用RNA干扰蜕皮激素下游的Hr3和ftz-f1转录因子,也能抑制L5神经元轴突分支从M1延伸到M2。相反,在薄板沉默EcR能促进L5神经元的树突在薄板上的生长(图2h)。上述研究提示,蜕皮激素通路调节L5神经元连接性的机制可能是一方面抑制该神经元在薄板上的突触发生,而另一方面促进其在髓质上的突触发生(图2i)。
*薄板(Lamina):果蝇大脑的某一脑区。
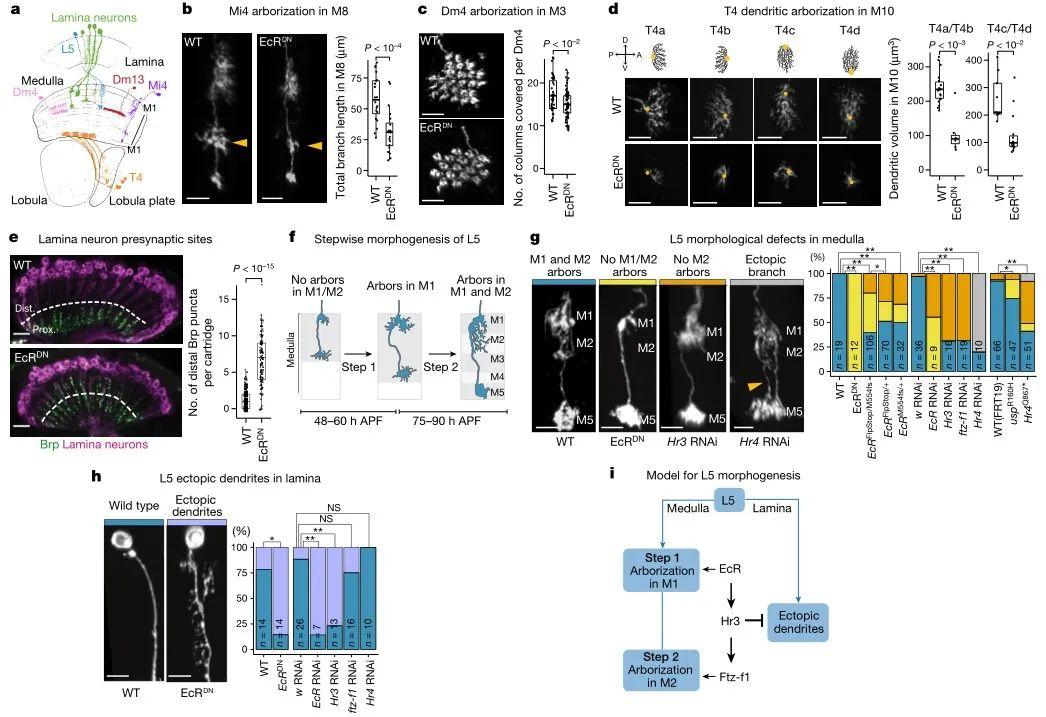 图2 蜕皮激素通路调节L5神经元连接性利用视神经元标记物分选细胞后,通过单细胞RNA测序技术比较WT型和EcRDN型L5神经元的转录水平,发现沉默EcR后有872个基因下调,517个基因上调(图3a)。对上述基因进行分析发现蜕皮激素通路能调控“连接基因”和细胞表面蛋白基因的表达,还能影响ATP合成和神经递质进入囊泡的过程(图3b)。值得注意的是,许多具有时间动态性的基因不受沉默EcR基因的影响,这表明可能存在其他的时间调控因子。
图2 蜕皮激素通路调节L5神经元连接性利用视神经元标记物分选细胞后,通过单细胞RNA测序技术比较WT型和EcRDN型L5神经元的转录水平,发现沉默EcR后有872个基因下调,517个基因上调(图3a)。对上述基因进行分析发现蜕皮激素通路能调控“连接基因”和细胞表面蛋白基因的表达,还能影响ATP合成和神经递质进入囊泡的过程(图3b)。值得注意的是,许多具有时间动态性的基因不受沉默EcR基因的影响,这表明可能存在其他的时间调控因子。
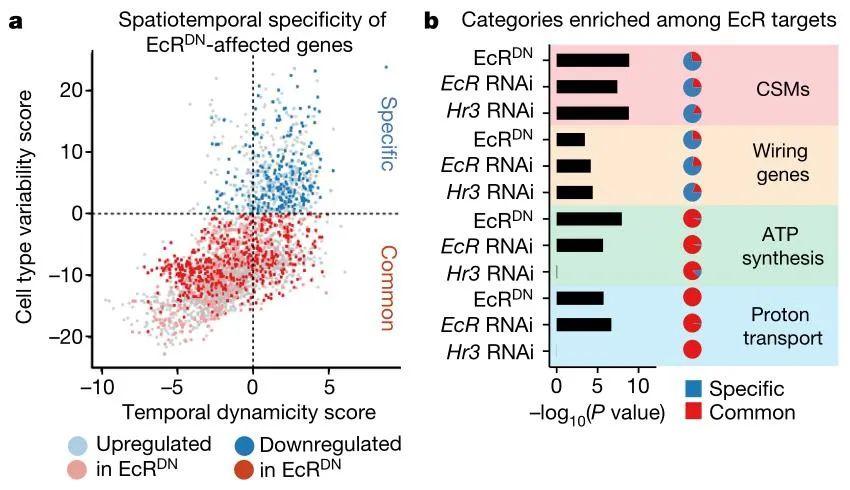 图3 蜕皮激素通路对连接基因的调节作用
图3 蜕皮激素通路对连接基因的调节作用
此外,有研究发现具有高细胞类型特异性的转录因子erm仅在有丝分裂后的L3神经元中表达,并且调控多个L3神经元的“连接基因”。虽然erm在整个发育过程中基因表达水平几乎恒定,但其下游许多基因的表达都存在动态变化(图4a)。进一步分析发现,erm和蜕皮激素通路共同调控的基因的表达量也会随时间发生变化,因此作者推测erm和蜕皮激素通路共同调节了L3神经元中“连接基因”的时间动态性。已有研究表明L3神经元能调控R8神经元向髓质生长,因此作者试图进一步探究该过程的调控因子。在验证沉默EcR基因能抑制R8神经元的突触生长后(图4b),作者对erm和蜕皮激素通路共同调控的12个基因进行了RNA干扰,随后分析R8神经元的突触发生情况。结果发现beat-IIa、CG4822、CG6044和Tpr2基因在该过程中起着重要作用(图4c)。其中beat-IIa和CG6044是免疫球蛋白超家族的蛋白质,能介导细胞识别过程。Tpr2能调节哺乳动物类固醇激素受体的活性,过度表达或敲除该基因都会导致激素受体活性降低(这与图4c结果相一致)。CG4822属于ABC转运蛋白家族,参与胆固醇和类固醇外排。
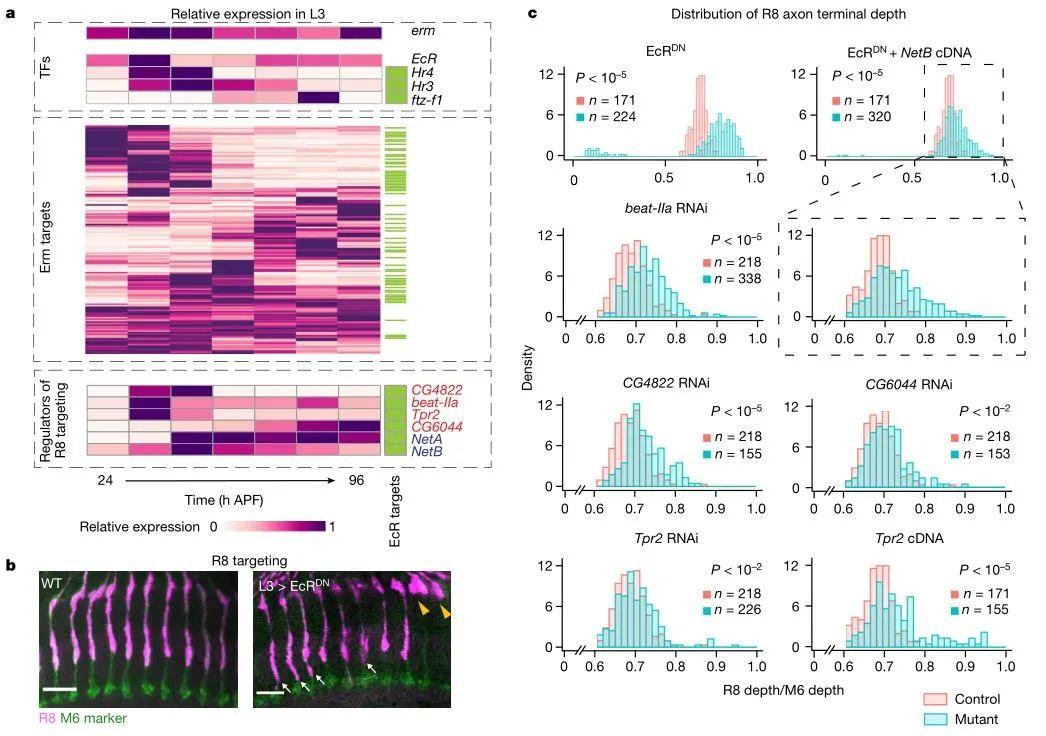 图4 erm与蜕皮激素通路的共同靶点
图4 erm与蜕皮激素通路的共同靶点
综上所述,该文章证明了在脑发育过程中蜕皮激素通过促进视觉系统神经元的轴突发生,调节了神经环路的连接。作者认为脑内存在一个高度整合的系统,用于调控神经元相互连接的细胞类型特异性以及时间动态性。由于该文章提出可能存在其它的时间调控分子,连接的时控机制还有赖于进一步的研究。
教授介绍
S. Lawrence Zipursky为加州大学洛杉矶分校生物化学系的教授,主要研究神经科学和发育生物学。他的团队以果蝇为模型,探究多种神经发育过程的调控基因。例如利用遗传和生物化学技术,揭示了编码细胞表面蛋白家族的Dscam1位点在果蝇神经环路形成中的作用。此外,他还与同事合作研究视觉刺激对初级视觉皮层细胞发育的影响。他的研究成果发表在Nature、Science、Cell等高分杂志上。
参考文献
Jain S, Lin Y, Kurmangaliyev YZ,Valdes-Aleman J, et al. A global timing mechanism regulates cell-type-specificwiring programmes. Nature. 2022. doi: 10.1038/s41586-022-04418-5.
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29








