抗肿瘤药物相关基因位点的检测
抗肿瘤药物相关基因位点的检测
“除了外伤,人类的一切疾病都与基因有关”
一日本生物学家诺贝尔奖得主利根川进

血浆药物浓度动态变化的规律
药动学 吸收
体内过程 分布 药物转运
排泄
代谢-→ 药物转化

肿瘤组织--疾病靶点 SNPs检测
CTCs、ctDNA、外泌体 ·对药物的应答
体液:尿液、唾液、脑脊液
对药物的毒性反应
基于药物基因组学和药物遗传学
基于分子分型的治疗策略
抗肿瘤药物相关基因位点的检测
-靶向药物的特点在于特异性和靶向性,其靶点主要有细胞表面受体和信号转导分子,药物靶分子的差异表达直接导致靶向药物的疗效个体化。
2012
1983
TYC+RAS
Normal cell cancor

循证(Evidence Based Medicine) Insert, guideline, evidence...
个体化(Individualized personalized)·Regemin/drug,dosage
肿瘤临床药学工作的需要

-化疗药物在体内过程中需要一系列转运体、代谢酶以及其他生物酶的参与,这些关键分子在不同人体内的活性各异,导致药物的毒性和耐药性不同。
抗肿瘤药物相关基因位点的检测指南标准
2015.07.29,国家卫计委医政司推出了两部试行版指南--《药物代谢酶和药物作用靶点基因检测技术指南》和《肿瘤个体化治疗检测技术指南》。
美国 FDA 公布了140余种药物建议通过遗传信息指导其合理使用, PharmGKB网站发布了百余个药物的临床药物基因组学的应用指南。
由NIH资助的PharmGKB遗传药理学
和药物基因组学数据库,旨在为全人 PharmGKB
类的个体化用药实现资源共享。


卡培他滨收后通过酶的作用转5-FU的前药,口服吸
化为5-FU而起作用
5-FU
替吉奥卡培他滨替加氟而起抗肿瘤作用。5-FU的衍生物,在体内经肝脏活化转变为5-FU替加氟
替吉奥 替加氟 吉美嘧啶
奥替拉西钾
氟尿嘧啶类
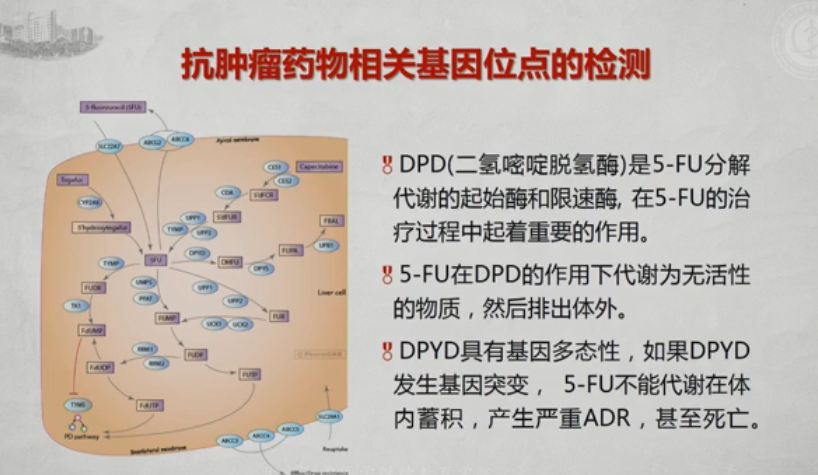
gDPD(二氢嘧啶脱氢酶)是5-FU分解代谢的起始酶和限速酶,在5-FU的治疗过程中起着重要的作用。
85-FU在DPD的作用下代谢为无活性的物质,然后排出体外。
8DPYD具有基因多态性,如果DPYD发生基因突变,5-FU不能代谢在体内蓄积,产生严重ADR,甚至死亡。


理论推导MTHFR酶活性
基因型及酶活性 677 CC 677 CT 677 TT
100% 66% 25%
1298 AA MTHFR酶活性为正常的 MTHFR酶活性为正常的66%, MTHFR酶活性为正常的
100%,叶酸利用正常 叶酸利用不足 25%,叶酸利用严重障碍
1298 AC83% MTHFR酶活性为正常的83%,48% MTHFR酶活性为正常的48%,21% MTHFR酶活性为正常的
叶酸利用不足 叶酸利用不足 21%,叶酸利用严重障碍
61% 40% 15%
1298 CC MTHFR酶活性为正常的61%, MTHFR酶活性为正常的40%, MTHFR酶活性为正常的
叶酸利用不足 叶酸利用障碍 15%,叶酸利用严重障碍
FOLFOX方案治疗,5-FU的应答率与MTHFR酶活性有关,MTHFR酶活性低,5.10-亚甲基四氢叶酸浓度高,更易与TYMS、FdUMP结合成复合物,提高5-FU的作用
8 补充叶酸(中高剂量),可提高胃癌患者生存率,但仅对于5-FU治疗的MTHFR酶活性高者有益,酶活性低者反而会增加死亡风险。
8MTHFR酶活性低者,补充活性5-CH₂-THF,能够维持细胞功能,降低毒副作用

伊立替康是一种无活性前体药,在人体组织内经羧酸酯酶2的活化转变 为活性代谢产物SN-38

伊立替康剂量限制性毒性反 UGT1A1 (TA)TAA (TAlTAA
应主要与SN-38水平增高有关。 SN-38-G ↓Expression TExpression
UGT1A1具有基因多态性,可导致
SN-38葡萄糖醛酸化速率产生50倍 Bie Low glucuronidation Normal glucuronidnticr
差异,主要表现在UGT1A1*28和 Damhoea Tolerance
UGT1A1*6. leucoceeria Nature Review
*28/*28
检测结论 UGT1A1*6为GG型,UGT1A1*28为TA7TA7型,该患者UGT1A1基因型为*28/*28纯合突变型,使
用伊立替康治疗,出现中性粒细胞减少、腹泻、乏力等毒副作用的风险高于*1/*1、*1/*28型。尤其是当使用中高剂量(>125mg/m2)的剂量时,*28/*28基因型者发生中性粒细胞减少的风险较腹泻、乏力更显著(Level 2A)。
个体化建议
该患者UGT1A1酶活性显著下降,根据指南(Professional Society guideline information for irinotecan and UGT1A1),对于高加索人群,如使用180~230mg/m2/2-3w方案,该基因型患者血液学毒性和消化道毒性发生风险较其它基因型者增高,建议初始伊立替康治疗剂量下调25~30%,尤其是伴有高风险因素的患者(performance status>3)。如使用≥240ma/m2/23w方案,该基因型患者发生血液学毒性(尤其是中性粒细胞减少)的风险更高,只建议该方案用于*1/*28或*1/*1基因型者使用
*6/*28 , *6/*6
检测结论 √UGT1A1*6为GA型,对SN-38(伊立替康的活性代谢产物)的代谢较AA型强,使用含伊立替康的治疗方案发生中性粒细胞减少的风险可能较GG型高(Level2A):
UGT1A1*28为TA6TA7型,使用伊立替康治疗出现中性粒细晌减少晚泻,手力等毒副作用的风险高于*1/*1.低于*28/*28(Level2A)。
√*6/*28与*28/*28*6/*6基因型者,使用伊立替康发生严重不自事件(尤其是中性粒细胞减少的风险增高(PMDA)。*28/*28基因型者,建议初始剂量下调25~30%(FDA)。
个体化建议 该患者UGT1A1基因型为*6/*28杂合突变型,UGT1A1的酶活性水平较*1/*1显著下降,有发生中性
粒细胞减少的风险。如使用中、高剂量伊立替康(>125mg/m2),建议密切关注患者用药后反应及监测血液学指标,及时调整给药方案。
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29








