《自然》肿瘤细胞磷酸甘油酸脱氢酶(PHGDH)代谢的异质性是癌症转移的关键
《自然》代谢的异质性是癌症转移的关键
肿瘤中磷酸甘油酸脱氢酶(PHGDH)异质性表达可以作为肿瘤侵袭性的标志
关于癌症转移,一直有两个问题困扰着科学家们的好奇心:拥有转移能力的癌细胞需要具备何种特质?它们又是如何获得这种能力的呢?
2022年5月18日,《Nature》在线发表比利时鲁汶大学的Matteo Rossi团队从代谢的角度给出了解答,他们发表在《自然》杂志上的题为《PHGDH heterogeneity potentiates cancer cell dissemination and metastasis》研究成果指出,原发性肿瘤中磷酸甘油酸脱氢酶(PHGDH)异质性表达可以作为肿瘤侵袭性的标志[1]。
Abstract
Cancer metastasis requires the transient activation of cellular programs enabling dissemination and seeding in distant organs1. Genetic, transcriptional and translational heterogeneity contributes to this dynamic process2,3. Metabolic heterogeneity has also been observed4, yet its role in cancer progression is less explored. Here we find that the loss of phosphoglycerate dehydrogenase (PHGDH) potentiates metastatic dissemination. Specifically, we find that heterogeneous or low PHGDH expression in primary tumours of patients with breast cancer is associated with decreased metastasis-free survival time. In mice, circulating tumour cells and early metastatic lesions are enriched with Phgdhlow cancer cells, and silencing Phgdh in primary tumours increases metastasis formation. Mechanistically, Phgdh interacts with the glycolytic enzyme phosphofructokinase, and the loss of this interaction activates the hexosamine–sialic acid pathway, which provides precursors for protein glycosylation. As a consequence, aberrant protein glycosylation occurs, including increased sialylation of integrin αvβ3, which potentiates cell migration and invasion. Inhibition of sialylation counteracts the metastatic ability of Phgdhlow cancer cells. In conclusion, although the catalytic activity of PHGDH supports cancer cell proliferation, low PHGDH protein expression non-catalytically potentiates cancer dissemination and metastasis formation. Thus, the presence of PHDGH heterogeneity in primary tumours could be considered a sign of tumour aggressiveness.
当原发性肿瘤中PHGDH高表达时,可发挥催化功能,提高肿瘤细胞增殖能力;而异质性或低表达时,则促进整合素发生糖基化,继而增强肿瘤转移和侵袭能力。
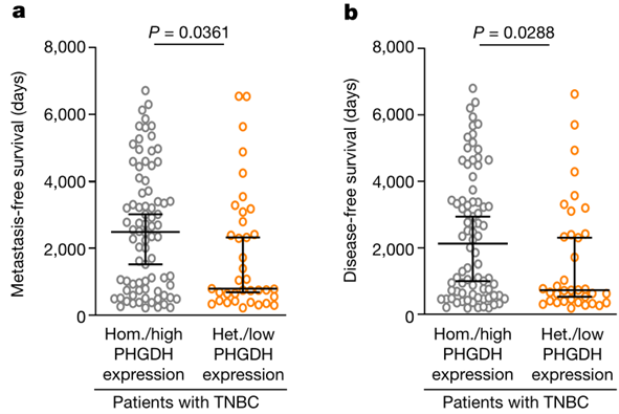
此外,与同质高表达PHGDH的患者相比,异质或低表达PHGDH患者的中位无病生存期与无转移生存期分别减少了约2.9倍和3.2倍。以上结果表明,异质性或低PHGDH表达是提示TNBC转移的一个重要指标。
异质或低PHGDH表达的TNBC患者无病生存期及无转移生存期缩短
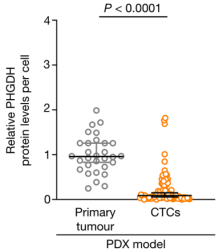
在PDX模型(BCM-3107-R2TG18)中,与原发肿瘤细胞相比,CTCs内PHGDH的相对表达量
接着,Rossi团队证实,早期在远端器官安家落户的肿瘤细胞与在循环系统中颠沛流离的同胞一样,均会表现出异质性或低PHGDH表达。那么,晚期转移瘤中的PHGDH表达还会维持异质性或低表达吗?
答案是不会!与早期肺转移病灶相比,晚期肺转移病灶中PHGDH表达显著增加。
但奇点糕就纳闷了,是谁给肿瘤细胞下达降低PHGDH表达的命令的呢?
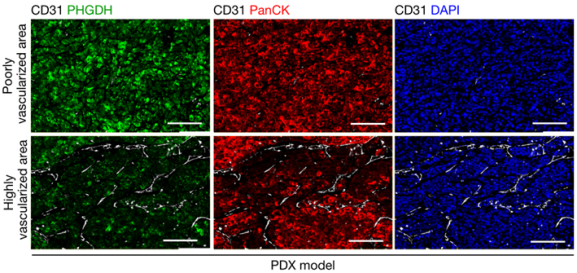
BCM-3107-R2TG18模型中原发肿瘤低血管化与高血管化区域内的PHGDH表达
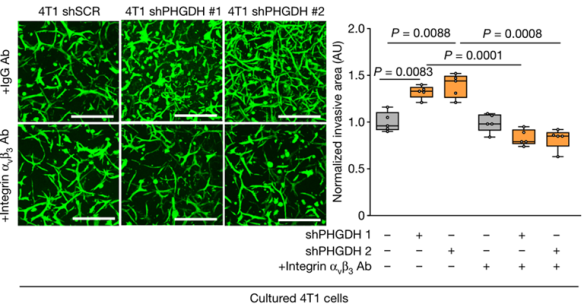
整合素αvβ3功能被抑制后,对照组与Phgdh沉默的4T1细胞的标准侵袭面积
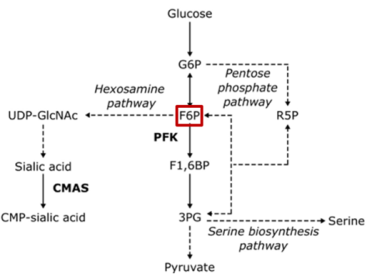
研究报道,整合素αvβ3唾液酸化确实有益于肿瘤细胞迁移和侵袭 [9-11]。而唾液酸由己糖胺-唾液酸途径产生,该途径截胡了糖酵解过程中的6-磷酸果糖(F6P),最终将葡萄糖代谢引向了唾液酸的合成。
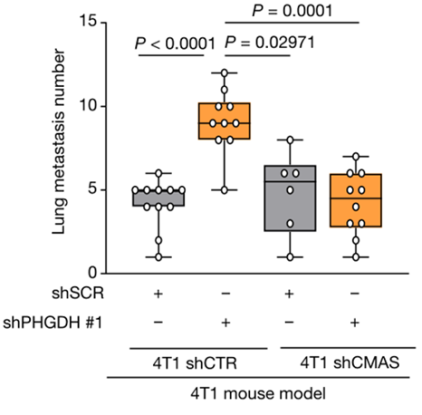
抑制己糖胺-唾液酸途径,对照组与Phgdh沉默的4T1小鼠模型中肺转移瘤数量
上述结果表明,PHGDH表达降低通过己糖胺-唾液酸途径促进整合素αvβ3唾液酸化,继而增强了原发肿瘤的转移与侵袭能力。
开头提到,代谢酶PHGDH的本职工作是催化3-磷酸甘油酸合成丝氨酸,表达过多就会让肿瘤细胞生长“嗨起来”。那么,PHGDH又是如何启动己糖胺-唾液酸途径,让肿瘤细胞动起来的呢?
这得说到PHGDH的“兼职”功能——稳定磷酸果糖激酶(PFK)活性。
Rossi团队发现,代谢酶PHGDH表达减少,PFK活性也会随之降低。但值得注意的是,这种相互作用并不依赖于PHGDH的催化功能,PHGDH过表达有或无催化活性时均能恢复PFK活性。
当PHGDH表达缺失后,糖酵解过程中的6-磷酸果糖无法被PFK代谢为1,6-二磷酸果糖(F-1,6-BP),这便会促使葡萄糖代谢转化为合成唾液酸的己糖胺-唾液酸途径。
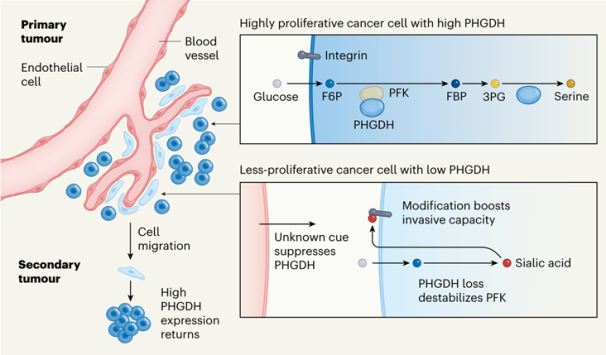
PHGDH的“本职”与“兼职”功能对肿瘤增殖、播散与转移的影响[13]
总的来说,这项创新性研究从代谢异质性的角度对肿瘤转移和侵袭提出了重要见解,并揭示了PHGDH“过山车式”表达影响肿瘤增殖、播散与转移的机制,为我们了解PHGDH的生物学效应开拓了一个新的领域。
原发性肿瘤中PHGDH异质性表达可作为肿瘤侵袭性的标志,不仅强调了代谢途径在整个癌症发展过程中的阶段性效应,也为肿瘤代谢治疗提供了新的研究思路。
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29