发育的基因调控
发育的基因调控
【导读】摩尔根在遗传学研究领域中的贡献众所周知,近期饶毅教授又以《发育的基因调控: 同源异形盒的发现及其意义》为题,讲述了发育基因调控研究中同源异形盒的发现及其意义的故事。
文章分成六个部分,包括细胞的身份和命运: 发育的决定,从遗传到发育: Lewis承前启后,研究果蝇的胚胎发育,“饱和突变”筛选控制发育的基因,同源异形盒(homeobox)与发育的调控,发育的分子生物学时代,以及研究果蝇发育对生物医学研究的推动。
其中具体的同源异形盒的介绍中,饶毅教授表示斯坦福大学的 David Hogness(1925 年~)首先提出现在所谓的基因组分析,他在 20 世纪 50-60 年代研究噬菌体的分子生物学和生物化学,1968 年, 在噬菌体热潮中领先的 Hogness 决定到美国的 Lewis、澳大利亚和德国的3个果蝇实验室学术休假, 学习果蝇和多线染色体。1972年, 在他的研究经费申请中, 他提出要将果蝇染色体的所有 DNA 分成有重叠的片段, 用噬菌体装到细菌中, 建成果蝇的基因组 DNA文库(genomic DNA library), 通过遗传表型和基因定位找到突变的基因(后来称为位置克隆, positional cloning)。
在多细胞生物中克隆基因, 果蝇相对比较容易。一是可以从已经克隆的基因, 利用染色体的突变(包括倒位和缺失等), 在染色体上行走(甚至跳跃)(Bender et al., 1983 年), 直至目的基因; 如果没有物理位置近的基因, 也可以直接利用唾液腺的多线染色体的粗大, 在遗传定位了基因的大体位置后, 用小刀从多线染色体上切下一段, 克隆后再进一步寻找目的基因。
用刀切染色体 DNA 只能在果蝇,而不能在其他常用实验生物上实现。拿到 DNA 后,可以制备标记的探针对唾液腺多线染色体进行原位杂交, 确定得到的 DNA 是否确实在遗传预计的染色体部位, 这也是果蝇的优点。Hogness 提出研究果蝇基因组一年后, 1973 年,旧金山加州大学的 Hebert Boyer 和斯坦福大学的Stanley Cohen 才发明大家常用的重组 DNA 技术。1974年, Hogness实验室用质粒将果蝇的DNA克隆到细菌中(Wensink et al., 1974年); 1978年, 当时在加州理工的 Tom Maniatis(1943 年~)等将果蝇、丝蚕和家兔的基因组 DNA 分别剪切后装入噬菌体载体, 制备了 3 个基因组文库(Maniatis et al., 1978 年)。
另外文章也谈到了果蝇发育研究对生物医学研究的推动作用,作者指出,最初在果蝇中发现控制发育的基因, 如同源异形盒的基因, 近 20 多年来不断发现其相应的人类基因参与疾病, 如一些 Hox 基因的突变导致外国和中国人群发生多种疾病等。
而且果蝇研究也提示了人工制造器官的可能性。摩尔根实验室很早发现果蝇第4号染色体上eyeless突变, 其后果是眼睛很小。当时在华盛顿卡内基研究所的 Rubin和 Alan Spradling (1982年)发现了 P转座子, 建立了果蝇的转基因技术。1995 年, Gerhing 实验室通过转基因技术将eyeless基因表达到身体其他部位(如翅膀、腿和触角), 发现可以形成异位的眼睛(Halder et al., 1995 年), 单个基因如此的开关作用令人感叹. 高等动物 eyeless 基因的同源基因称 Pax6, 其缺失导致小鼠眼睛减小, 人眼睛的虹膜缺失。在原理上, 通过Pax6 的研究, 很大程度上修改了以前认为眼睛在演化中出现 40 多次而毫无保守机理的想法, 认识到虽然完整的眼睛确实多次独立演化而成, 但感光结构的前体可能有共同的分子机理. 不过在应用上, 未能通过单独表达 Pax6 基因或几个基因诱导产生高等动物的眼睛, 迄今不明能否用这一途径人工制造器官。
文章最后指出,果蝇发育的研究已逾百年, 从被人所忽视到波澜壮阔, 出现很多超乎预料的结果, 除直接帮助人们理解果蝇发育的原理和基因, 也发现了新的信号转导通路, 推论了普适性原理, 推动人们发现高等动物发育的基因和原理, 提出了控制基因制造人工器官的可能, 帮助找到了理解一些人类疾病的基因, 发明了从突变找基因的一般性方法。
以下为饶毅全文
贡献主要在于遗传学的美国科学家Thomas Morgan实验室,自1910年代起在其研究过程中就发现了影响发育的基因突变。1930年代至1970年代果蝇研究整体处于相对寒冷期,其他一些生物(如粗糙链孢霉、玉米、细菌、噬菌体等)对遗传学有较大贡献。1950至1970年代,加州理工学院的Edward B Lewis通过遗传学仔细分析果蝇发育的突变、深刻思考基因的规律。
发育生物学的第一个高潮在德国Wilhelm Roux等开创实验胚胎学的十九世纪后期,第二个高潮在1920年代以德国Hans Spemann为代表的科学家用两栖类研究胚胎诱导,第三个高潮仍在德国:1980年前后,在德国海德堡工作的德国女科学家Christiane Nüsslein-Volhard和美国科学家Eric Wieschaus以遗传突变广泛筛选控制果蝇发育的大批基因,使果蝇研究光彩绚丽。西方和日本很多分子生物学家加入果蝇研究,新的发现层出不穷。在遗传学带领和分子克隆技术推动下研究果蝇,1984年同源异形盒(homeobox)被发现,使发育生物学与分子生物学两个学科的重要领域在机理上得以会合:调节基因转录可以控制发育。
研究果蝇的原理在很多生物普遍适用,发现大量新的基因及其功能,阐明一些信号转导通路,表观遗传学有些基因最初也发现于果蝇,而最初从果蝇发现的基因(特别是含同源异形盒的基因)在高等动物也起重要作用,不仅有些参与相同的发育过程(特别是身体前后轴),还参与其他重要过程,包括一些肿瘤的发生。从果蝇和高等动物保守的发育遗传学规律,迄今尚有难以完全理解的。果蝇研究结果提示能够人工用基因制造器官,迄今未知能否在高等动物中实现、如何实现。
细胞的身份和命运:发育的决定
一个由很多系统、组织和细胞组成的动物来源于一个细胞:受精卵。它经过分裂可以变成很多细胞,这些细胞如何变成不同细胞,取得不同的身份(identity)、有不同的命运(cell fate)?这是发育生物学的一个核心问题。有了不同身份的细胞,才能形成不同的结构,产生不同的功能:红细胞运输氧气、心肌细胞泵血、神经细胞参与思维…。
研究发育的途径之一是遗传学,通过研究基因突变的后果,推论基因是否参与、如何参与发育。基因突变可以影响发育,而多见的变化是某些结构没有了、或增大了。这些变化可以有好玩的解释,有时也可以有无趣的解释,比如可以观察到的发育异常非基因的直接作用、而是在基因突变与最后看到的表型之间有很多环节。很多研究者曾忧虑自己研究的基因不能提供较有意义的信息。
发育过程最容易引人入胜的变化,是身体的一种结构变成另一种结构。英国的Bateson(1894)提出homeosis的概念(“同源异形”),用于描述一种结构变的像另外一种结构,他举例包括:观察到有些蜜蜂没有腿、而在腿的位置长出触角,将运动器官(腿)变成了嗅觉器官(触角)。在细胞水平,同源异形是一种细胞变成另一种细胞。基因突变造成同源异形表型,称为同源异形突变、被改变的基因称为同源异形基因(homeotic genes)。
在果蝇中,有个基因复合体称为Bithorax Complex(BX-C,双胸复合体),其DNA序列突变后可出现同源异形突变,结果是一个节段的身份变成另一节段的身份。第一个bithorax(bx)突变是摩尔根的学生Calvin Bridges于1915年发现、由Bridges和Morgan(1923)报道,果蝇成虫第三胸节段(T3)的残翅变成像正常果蝇第二胸节段(T2)才有的翅膀,使bx突变种果蝇有两对翅膀。摩尔根的学生Alfred Sturtevant的学生Ed Lewis对BX-C的研究从1940年代末到1970年代后期,下一节介绍。
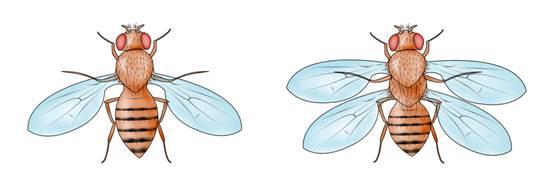

Balkashina(1929)发现aristopedia突变,果蝇触角的末端为腿的末端所替代; Bridges和Dobzhansky(1933)报道1931年Bridges发现的proboscipedia突变,口器的部分结构为腿的末端所替代。1940年代后发现更多触角变成腿的突变,是基因功能增加的突变,包括称为Antennapedia(Antp,“角脚”)的基因。1980年,美国印第安纳大学的Tom Kaufman提出Antennapedia也属一个基因复合体,含多个基因,包括antennapedia、proboscipedia(pb)、sex combreduced(Scr)等,称为“角脚复合体”(ANT-C),其作用是控制头和胸节段的形成,缺乏这些基因时,胸二节段(T2)和胸三节段(T3)成为胸一节段(T1)。
1960年代至1970年代,坚持用果蝇研究发育的还有西班牙的Antonio García-Bellido、瑞士的Walter Gehring、美国的Postlethwait和Schneiderman (1969, 1971)等。Ecker(1929)发现engrailed突变。1972年,García-Bellido和研究生报道,engrailed突变使T2节段的后半部变成前半部,继续研究提出发育的compartment概念,不是表观看到的形态的框架,而是发育的单位。明确提出同源异形基因是调节性节段的形成(Garcia-Bellido and Santamaria,1972)。García-Bellido(1975)进一步提出:activator基因确定selector基因表达的范围,selector基因控制realizator基因,后者具体确定细胞命运。在此概念中Bithorax和engrailed都是selector基因。García-Bellido的想法为Crick和Lawrence(1975)所特别推介。
从遗传到发育:Lewis承前启后
摩尔根本人对发育很感兴趣,他研究果蝇以前就研究过发育和再生,1897年他出版的第一部书是《蛙卵的发育:实验胚胎学导论》、1901年出版《再生》。他晚期仍醉心思考发育,1926年出版《遗传学与发育生理学》、1929年出版《实验胚胎学》、1934年出版最后一部书是《胚胎学与遗传学》。他自然认为遗传学对发育生物学有意义,摩尔根本人用果蝇做研究以后、还用其他动物做实验。
在1950到1970年代的三十年间,用果蝇遗传研究发育的科学家是加州理工学院的Ed Lewis (1918-2004)。Lewis在明尼苏达大学念本科时遗传学老师CP Oliver是Hermann Joseph Muller的学生,而Muller是Morgan的学生。Lewis到加州理工跟Morgan的另一位学生Sturtevant做研究生、于1942年获博士。他用果蝇研究了多个问题,而最为人所知的是果蝇发育。
这一系列工作起初不是为研究发育,而是他延续他自己从1939年起研究基因精细图谱(fine mapping)、顺反(cis-trans)检测等工作。前人有关基因重复(gene duplication)产生新基因、Sturtevant有关基因的位置效应,影响Lewis的研究。在研究演化产生的新基因与相邻基因互相作用的过程中,他选用了bx突变。果蝇的胸部有三个节段,T2(胸二)节段长翅膀、T3(胸三)节段长平衡棒(也称残翅,haltere)。Bridges发现bx突变导致T3节段变成T2节段,这样的果蝇有四个翅膀、而缺乏平衡棒。Bridges于1919年再发现bxd突变,表型也是T3变成T2,bxd在基因图谱上的位置与bx相近,而遗传上却比较奇怪:bx与bxd不能互补。1934年Hollander发现Bxl突变种、给Bridges研究过,Bxl后来被Lewis称为Ubx。Ubx/+表型微弱,Ubx/bx表型等于bx/bx,Ubx/bxd表型等于bxd/bxd。Lewis认为它们可能是三个在演化上有关系、而有相互作用的基因,他称为“伪等位基因效应”(pseudoallelism)(Lewis,1951)。基因图谱定位发现三个“基因”中,bx最靠近染色体着丝点、其右0.02单位为Ubx、再右0.01单位是bxd。Lewis进一步发现bx与bxd影响节段中不同而互补的部分:bx只使T3前部(anterior T3)变成T2前部(anterior T2),而bxd使T3后部(posterior T3)变成T2后部(posterior T2)、而且还将腹1(A1)节段变成胸节段。Lewis提出,bx与bxd在演化中来源于基因重复(duplication),以T2节段为基态,促进T3节段和A1节段的发育。也就是说,在1951年Lewis意识到染色体上相邻的基因对应于身体上相邻的部分。到1955年,他发现了更多的突变,如pbx、Cbx等等,他认为这几个相邻的基因功能相关,在发育中有序地起作用。
1953年Watson和Crick的DNA双螺旋模型出来以后,具体如何定义基因再度成为问题。孟德尔时代确定不同性状的因子是后来认为的不同基因。摩尔根时代的突变被认为反映了基因。不过,如何确定表型相似的两个突变是位于两个不同基因、还是同一基因的两个不同突变?那时靠观察是否两个突变能有重组,做多个交配、看很多后代,如果两个突变可以有重组,说明它们是不同基因的突变,如果不能观察到重组,说明它们是同一基因上不同的突变。到DNA时代以后,基因在DNA水平如何定义,从哪里到哪里是一个基因?美国的Seymour Benzer(1921-2007)更新基因的遗传学定义。他用噬菌体的实验表明,突变就是DNA碱基对的改变。突变小到一个碱基对的改变、大到很长一段DNA的改变。突变反映了基因、但不等同于整个基因,两个突变可能是在同一个基因内部、也可能是在两个不同基因。不同染色体上的突变是不同的基因,很好检测。但是,如何检测同一个染色体上相近位置的两个突变,确定它们是否同一个基因、还是不同基因?Benzer于1957年在会议上、1959年正式发表文章提出顺反检测(cis-trans test)来证明是否同一基因还是两个基因。顺反检测将两个突变放在同一个染色体(顺)、和配对的两个染色体(反)上分别检测表型。顺式无表型、反式有表型的两个突变属于同一基因,顺式和反式皆无表型的两个突变属于两个基因。
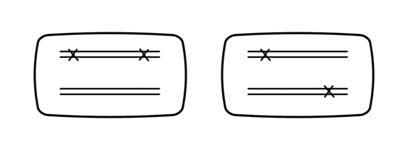

Lewis在1951年分析果蝇时含有顺反检测。他在1955年实际已提出互补检测(Lewis,1955)。他发现:bx与Ubx的顺式bxUbx/+ +表型微弱、反式bx +/+ Ubx表型很强,Ubx与bxd的顺式Ubxbxd/+ +只显Ubx表型、反式Ubx +/+ bxd显bxd的表型(Lewis,1951)。Lewis通过表型推论bx和Ubx两基因有相互作用,Ubx与bxd有相互作用。等五十年代末后按Benzer的定义,顺式无表型、反式有表型的两个突变应该是同一个基因的两个突变,而不是两个基因,对Lewis的结果如果简单地推论,可以说:他研究的不是多个基因,而是编码同一个蛋白质的基因上不同位点的改变?对此,Lewis感到迷茫。当然,对Ubx与bxd的顺反检测得到结果并非最简单。
1961年,法国遗传学家François Jacob(1920-)和Jacques Monod(1910-1976)提出操纵子学说,认为基因有结构部分和调节部分(当时称为结构基因、调节基因,相当于现在编码蛋白质部分和调节区域)。在细菌中几个功能(比如半乳糖代谢)相关的基因可以组成一个操纵子(operon),但在高等生物很少见相关功能的基因聚集在一起。比如,Lewis指出孟德尔研究的几个影响豌豆豆荚颜色和皱褶的基因相距很远。
一直到1950年代,Lewis研究的注意力在基因发生和演化,即使他实际已经开始了发育研究。1963年,Lewis明确将注意力转移到发育。研究相邻的五个基因:bx Cbx Ubx bxd pbx。他提出这些基因形成一个复合体(gene complex),正如细菌的操纵子里面有几个功能相关的基因,这些相邻基因参与相关的功能:确定果蝇身体的节段。Lewis检测基因的效应作用后提出:bx、 Ubx、bxd和pbx等突变造成基因功能缺失导致表型(loss-of-function,缺失功能突变),而Cbx突变造成基因功能增加导致表型(gain-of-function,增加功能突变),这是遗传学第一次明确使用这两个词,以前常用Muller提出的hypomorph、neomorph等词。
因为发现Cbx +/+ Ubx有Cbx的表型(T2变成T3)、而CbxUbx/++无表型),而且两种突变同时存在时仅有可能显Cbx表型、不显Ubx表型,Lewis提出Cbx的作用是调节Ubx。在无Cbx突变的情况下,Ubx缺失功能性突变(Ubx-)导致正常Ubx(Ubx+)功能降低,表型为T3变成T2。而在有正常Ubx+时,Cbx导致正常Ubx+功能增加,表型为T2变成T3。他进一步提出bx和Cbx两个都是调节子(operator),调节Ubx、bdx和pbx。通过分析遗传嵌合体,他发现这些基因的作用都是细胞自主的,也就是说有突变的细胞有表型,而不是影响邻近的细胞(在分子机理上,我们现在的理解是有些基因产生的蛋白质产物可以弥散作用于其他细胞,而不是在产生蛋白质的细胞本身起作用,这种是细胞非自主作用cell non-autonomous)。
1964和1968年,Lewis还发表了有关文章(Lewis,1964,1968),其后十年只在系里年会、以及偶尔在学术报告讲其结果,未发表相关论文。
1978年,英国剑桥的发育遗传学家Peter Lawrence(1941-)建议Nature主编邀请Lewis撰文。Lewis(1978)的文章“控制果蝇节段形成的基因复合体”总结了自己多年的研究,而且主要用果蝇胚胎的节段进行研究。因为实际上影响果蝇胸腹节段形成的基因,突变后多半导致死亡,不能存活到成虫期,最初那些可以看到成虫的都是一些特别突变,没有完全失去基因功能,要研究多数的突变,需要观察胚胎。
在1969年至1977年无论文发表期间,Lewis继续做研究。他发现一个缺陷型突变(Df P9),失去相当一段染色体,缺失整个双胸集合区,他从此命名基因集落为双胸复合体(Bithorax complex,BX-C)。双胸复合体全部缺失的表型是第一期幼虫致死,胚胎的T3至A8节段全部变成T2节段。在较大段的染色体缺失的基础上,Lewis逐段加回小段染色体,从而确定不同段的功能。他发现加入越长的片段,体节恢复越多:如果在Df P9基础上,通过Dp 100引入bx和Ubx,可以恢复T3,如果通过Dp P10引入bx、Ubx、bxd和pbx,可以恢复A1节段。如果加其他基因,包括iab2、iab3、iab8等,才能恢复所有8个腹节段。他发现以后称为“共线性”(co-linearity)的规律:调节身体偏前端体节的基因,在双胸复合体内部靠染色体近端;而调节身体偏后端体节的基因,在染色体上偏远端。
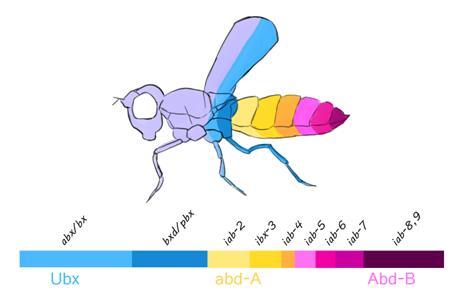

Lewis(1978)总结了控制BX-C的6条规则,1)基因的抑制和去抑制常由顺式调节元件控制;2)基因一般是单独而不是协调性地抑制;3)BX-C受一个主要的调节基因Pc等所负调控;4)在一个节段去抑制的基因在其后面的节段都去抑制(也就是表达);5)越靠后面的节段,越多的BX-C基因去抑制;6)越靠复合体近端的基因,越可能去抑制。其中,Lewis妻子Pam在1947年发现Pc(Polycomb,“多梳”)基因,Lewis证明Pc是BX-C的主要负性调节基因。到1980年代以后,他和实验室的人(特别是Ian Duncan)对Pc的抑制作用还有更多研究。Pc到近年很多人感兴趣,是表观遗传学的一个热点。
Lewis研究BX-C时,还提出和考虑了果蝇胸节段翅膀形成的演化:果蝇是T2节段长出一对翅膀,T3节段长残翅,而其演化的前体是两对翅膀,T3也长翅膀,演化再远的前体其腹部也长翅膀。BX-C的作用是抑制T3以及腹节段长翅膀,使它们不同于T2。
1950到1960年代Lewis研究辐射与癌症的关系时,他认为“辐射可以致癌”的结论与美国政府主持原子能的将军发生冲突,遭多方面攻击,包括有科学家声称他的分析不科学。Lewis多年坚持发表多篇论文以事实和分析得出科学结论,最终大家接受他的结论,而不相信外行、或相信貌似公允但为偏见和利益发言的那些科学家。
Lewis发明了遗传研究很有用的工具。遗传学研究经常要诱导突变,如Muller的物理方法,还有化学方法。Lewis和Bacher (1968)发现ethyl methanesulfonate(EMS,甲基磺酸乙酯)是很好的化学诱变剂。后来知道EMS通常造成很小的突变(常常是点突变),而突变位点分布相对比较均匀,被应用于果蝇和其他动物的遗传研究,目前仍与ENU(N-ethyl-N-nitrosourea)为常用的化学致变剂。
研究果蝇的胚胎发育
果蝇一生分几个时期,在室温中:受精后开始胚胎发育(embryo),24小时后变成一期幼虫(first instar larva),6天左右经过两次蜕皮变成三期幼虫,其后结茧蛹化(pupation),4天左右羽化(eclosion)为成虫(adult),八小时后性成熟,其后可以活几十天。
为什么二十世纪前几十年少有科学家研究果蝇胚胎发育?除因其体积小以外,它与人类很不一样也是原因。果蝇胚胎最早是合胞体,细胞核分裂而在同一个细胞共享细胞浆,细胞核分裂达256个细胞核时,细胞核才移动到细胞膜附近,继续分裂至6000个细胞核左右才形成细胞膜、分成6000个细胞。而人类与一般脊椎动物的受精卵一个细胞分裂成为两个、两个成为四个、如此以往,细胞核一直分在不同的细胞中。这种巨大的差别,使人们觉得研究果蝇的胚胎对于理解高等动物胚胎发育意义不大,所以不是很多人热衷研究果蝇的胚胎。
摩尔根时代用遗传研究发育还有一个障碍:当时发育的主要对象是胚胎学,而摩尔根与学生们重视成虫的表型,不重视胚胎,虽然他们并非完全无视胚胎。曾有人认为早期胚胎发育不是遗传控制,而是简单的生长和扩大,Donald Poulson的一系列研究推翻了这种想法。Poulson在加州理工做研究生的时候开始描述果蝇胚胎发育,研究染色体异常与胚胎发育的关系。他长年在耶鲁大学任教期间继续这些研究,包括确定了Notch的胚胎表型是表皮减少、神经系统增加,后者增加的代价是表皮减少,从而提示细胞可能需要选择变成神经、还是表皮(Poulson,1937, 1940, 1950)。
Lewis从1950年代到1960年代研究果蝇成虫的发育,1970年代后,他和其他人都主要研究胚胎的发育。
实验胚胎学的发源地是德国,在十九世纪末以Wilhelm Roux(1850-1924)研究胚胎两个细胞差别为代表,而二十世纪初以Hans Spemann(1869-1941)于1924年发表的组织者(organizer)实验为代表。有趣的是,当德国经过希特勒时代后科学大幅度滑坡后,1980年代再次成为世界发育生物学的中心,且吸引一批美国人到德国做博士后,短暂、局部地逆转当时已形成的欧洲到美国留学潮。
用遗传学研究果蝇胚胎发育,带来发育生物学研究第三次高潮,其主力之一是女科学家Christiane Nüsslein-Volhard(1942-)。在迄今仍少见女科学家的德国,Nüsslein-Volhard的成功很突出。因经常不做家庭作业、有几门功课考分不高,她被中学老师评语称“决定性懒惰”的学生,认为她只对自己感兴趣的东西用功、不管其他。她研究生时期的分子生物学论文发表于Nature,于1973年获博士。那时分子生物学是方兴未艾的热门、果蝇已经多年冷门,她的同学后来有发展分子生物学技术而既做好事业又致富的,她却自己读文献、找人交谈,想用遗传学研究发育,读到果蝇的bicaudal(“双尾”)突变后进一步思考,最后决定于1975初去瑞士Gehring的实验室做博士后学习研究果蝇两年。她回德国找不到教职而到Klaus Sander的昆虫实验室再做了一年的博士后,学习实验胚胎学的经典方法。
Nüsslein-Volhard博士后期间没太多结果,不过她在Gehring实验室与其他人合作发明改进了两个小而有用的技术,从而可以较快地收集大量胚胎、用化学清洁剂后可以较清晰地观察胚胎,为她以后的工作埋下了伏笔。她在Gehring实验室还为以后的合作建立了基础:认识了美国科学家Eric Wieschaus(1947-)。
生于美国南方天主教家庭的Wieschaus,在印第安纳的圣母大学念本科后到耶鲁念研究生,第一年跟Poulson学了果蝇的胚胎发育,第二年转为了当时在耶鲁任教的Gehring的研究生,并跟Gehring到瑞士巴塞尔,曾试图体外培养果蝇胚胎细胞未果,以制造遗传嵌合体研究果蝇不同部位是否共有相同细胞来源为研究生论文。
1978年,德国海德堡新成立“欧洲分子生物学实验室”(EMBL),让Nüsslein-Volhard和Wieschaus分别主持青年科学家小组的工作,他们共用实验室空间和技术员,不久决定合作,大量筛选影响果蝇胚胎发育的基因。
“饱和突变”筛选控制发育的基因
1978年至1980年的三年中,Nüsslein-Volhard和Wieschaus的工作改观了发育生物学。他们希望筛选影响特定发育过程(如胚胎节段形成)的所有基因。一般认为他们首创筛选控制多细胞生物特定生物学过程全部基因的“饱和突变”(saturation mutagenesis)或“饱和筛选”。在单细胞生物,美国遗传学家Leland Hartwell于1970年已做过大量筛选:用酵母找控制细胞分裂周期的基因。但研究多细胞生物的科学家只做单个、或几个基因,而Nüsslein-Volhard和Wieschaus(1980)通过饱和突变筛选了很多基因。
Nüsslein-Volhard和Wieschaus工作的理论基础是前人已研究了影响节段形成的基因,多半在成虫、少数在胚胎,他们决定要找影响胚胎节段形成的所有、或大多数基因。对一个一个基因分别进行突变,然后确定是否影响了特定的过程,这就是饱和突变。如何知道突变已经饱和?一是应该有多个基因突变导致相似的表型,二则同一基因应该有多次不同的突变。他们的工作还有技术基础,如:1)他们假设突变了参与胚胎节段形成的基因很可能导致隐性致死,所以用Muller的平衡致死系为起始寻找基因;2)要研究胚胎发育,需要能快速大量观察胚胎的形态,这依赖于他们改进Nüsslein-Volhard在博后期间的技术,可以让胚胎发育刚完成的一期幼虫透明,而可以通过胚胎表面的刚毛分布(位于腹侧、每个节段不同、节段内前后有别),识别果蝇胚胎的节段和节段前后;3)他们需要造成基因突变,每次突变一个基因,且基因改变要比较小,用Lewis和Bacher于1968年发明的EMS做化学诱变剂可以满足要求。

![]()
在Nüsslein-Volhard和Wieschaus的工作以前,已知影响果蝇胚胎发育的基因有两类:一类如bicaudal,是母亲的基因影响胚胎,表型是影响胚胎全局,突变种的胚胎有两个尾部结构,长在首尾两端,没有头、胸、以及腹的前部,这种表型提示正常bicaudal基因参与前后轴(Anterior-Posterior Axis)的形成;另一类是同源异形突变,导致一个节段变成另外一个节段,反映被突变的基因正常时参与确定节段身份(segment identity)。在这两种之间,应该还有其他基因。
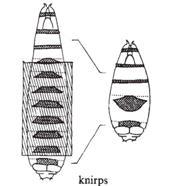
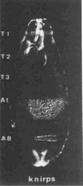
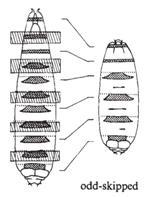
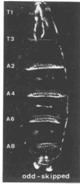
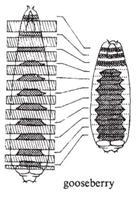
果蝇有四套染色体。在筛选了第二号染色体上四千多个突变、加上平时收集的一些突变后,Nüsslein-Volhard和Wieschaus选择其中15个突变,总结其结果得出推论发表于1980年的Nature。他们报道的15个基因(6个前人发现、9个他们发现),在胚胎中导致的表型可以归为三类:1)区段基因(gapgenes),这类基因突变导致胚胎多个节段缺失,如knirps突变缺失A2至A7节段,Krüppel突变缺失T1至A5、且有A6的镜像重复,hunchback(“驼背”)突变缺失T2和T3;2)成对规则基因(pair-rule genes),如odd-skipped(“奇跳”)突变缺失T2、A1、A3、A5、A7节段,even-skipped(“偶跳”)突变缺失T1、T3、A2、A4、A6、A8节段,paired突变缺失T1、T3、A2、A4、A6、A8节段,等;3)节段极性基因(segmentation polarity),每个节段内有前后极性,这些基因突变导致节段内极性改变,如gooseberry突变导致节段内后半缺失,而前半镜像重复。有些基因参与两个过程,如engrailed突变时,既导致成对问题、也导致节段内部的问题,说明一个基因可以多次在不同过程中发挥作用。


![]()
在讨论中,Nüsslein-Volhard和Wieschaus从节段形成扩展到前后轴形成,提出:胚胎整体的前后由母性基因提供的产物所确定,其后胚胎自己的基因起作用,逐步从大的多节段、到两个节段、到每个节段一步一步确定,而他们发现的基因就在这些步骤中起作用。这样,他们通过遗传突变种的表型推测了发育的机理,并发现了具体的基因,供进一步验证和研究,了解发育是否分步进行,各个基因如何单独或合作参与发育。
他们在筛选第二号染色体后,继续筛选了第3号染色体、X染色体(第一号)和比较小的第四号染色体,寻找影响果蝇幼虫表皮发育的基因,共发现了约130个基因(Nüsslein-Volhard,Wieschaus and Kluding,1984;Wieschaus,Nüsslein-Volhard and Jürgens,1984),一系列文章发表于德国的发育生物学刊物:RouxArchive of Developmental Biology,以德国实验胚胎学家Roux命名,原为德文的杂志、这时已改用英文。
此后,Wieschaus离开海德堡回美国,一直在普林斯顿研究果蝇胚胎发育,特别是肠胚化过程(gastrulation)中细胞的移动等。Nüsslein-Volhard不久得到图宾根的马普研究所职位,以后一直在图宾根。
Nüsslein-Volhard和Wieschaus在1980年报道的15个基因是受精卵发育开始后的胚胎发育过程由胚胎本身的细胞所表达。Nüsslein-Volhard和其他实验室另外还特意筛选了母性效应基因(maternal effect genes)。母性效应基因最初是用遗传学定义:母亲的基因型、而不是胚胎本身的基因型,决定胚胎的表型。具体是因为受精卵和胚胎是在母体进行发育,所以,父亲对胚胎只是贡献DNA,而母体不仅贡献DNA,也控制胚胎发育的一些步骤,这些控制是通过母体基因表达在母体细胞,比如多个围绕受精卵的母体细胞形成一层,这些细胞的位置和特性,影响受精卵和胚胎的发育。另外,有些母体合成的RNA、或蛋白质进入卵细胞以后影响胚胎发育。筛选母体影响后代的基因,从设计和分析角度,比筛选在胚胎内起作用的基因要麻烦,迄今常很难在其他动物研究母体对后代发育的影响,不过研究果蝇的人有办法。几个实验室在果蝇中发现约30个影响胚胎发育的母体效应基因,其中Nüsslein-Volhard实验室着重研究了bicoid,其功能缺失时,果蝇胚胎有两个尾、分别在首尾两端,没有头部。后续遗传、发育和分子生物学的研究,显示bicoid是果蝇早期AP轴形成的关键基因。
同源异形盒(homeobox)与发育的调控
Stanford大学的David Hogness(1925-)首先提出现在所谓的基因组分析。他从1950年代到1960年代研究噬菌体的分子生物学和生物化学。1968年,在噬菌体热潮中领先的Hogness决定到美国的Lewis、澳大利亚和德国的三个果蝇实验室学术休假,学习果蝇和多线染色体。1972年,在他的研究经费申请中,他提出要将果蝇染色体的所有DNA分成有重叠的片段,用噬菌体装到细菌中,建成果蝇的基因组DNA文库(genomic DNA library),通过遗传表型和基因定位找到突变的基因(后来称为位置克隆,positional cloning)。
Hogness认为研究果蝇要能像分析噬菌体一样,从表型到DNA。他的提议很大胆,因为噬菌体比果蝇简单很多:噬菌体是细菌的病毒,由DNA和蛋白质组成,细菌是单细胞,噬菌体没有细胞,而果蝇是多细胞生物;Hogness于1960年代研究的l噬菌体其DNA后来知道仅4万8千碱基对(bp),而2000年知道果蝇的基因组含1亿6千万bp,是前者的四千倍。
回过头来看,在多细胞生物中克隆基因,果蝇相对比较容易。一是可以从已经克隆的基因,利用染色体的突变(包括inversion、deletion等),在染色体上行走(甚至跳跃)(Bender, Spierer and Hogness,1983),直至目的基因;如果没有物理位置近的基因,也可以直接利用唾液腺的多线染色体的粗大,在遗传定位了基因的大体位置后,用小刀从多线染色体上切下一段,克隆后再进一步找目的基因。用刀切染色体DNA只能在果蝇,而不能在其他常用实验生物实现。拿到DNA后,可以制备标记的探针对唾液腺多线染色体进行原位杂交,确定得到的DNA是否确实在遗传预计的染色体部位,这也是果蝇的优点。
Hogness提出研究果蝇基因组一年后,1973年旧金山加州大学的Hebert Boyer和斯坦福大学的Stanley Cohen才发明大家常用的重组DNA技术。1974年Hogness实验室用质粒将果蝇的DNA克隆到细菌中(Wensinket al., 1974),1978年当时在加州理工的Tom Maniatis(1943-)等将果蝇、丝蚕和家兔的基因组DNA分别剪切后装入噬菌体载体,制备了三个基因组文库(Maniatis et al., 1978)。Hogness实验室1978年克隆了BX-C的DNA、1979年确定Ubx基因、结果于1980年在斯坦福大学医学院生化系的学术会议上展出,但直到1983年才正式报道克隆BX-C的DNA(Bender et al., 1983a),同年Hogness实验室与Lewis合作报道BX-C遗传突变在DNA的改变,从而将BX-C中特定基因与已有遗传突变联系起来(Bender et al.,1983b)。Hogness实验室在几篇摘要中报道他们确定了BX-C编码Ubx mRNA的部分,其博士后Akam回英国剑桥后于1983年报道用原位杂交观察到Ubx的mRNA确实在第三期幼虫表达于可以预计的区域(T3和腹节段的成虫盘,imaginal discs)(Akam, 1983a, 1983b)。Ubx基因较长,基因组DNA有七十多kb(千碱基对),而转录多个mRNA,Hogness实验室一时未发表其编码的蛋白质序列。
1983年,美国印第安纳大学Kaufman和瑞士巴塞尔大学生物中心的Gehring两个实验室报道克隆了ANT-C(Scott et al., 1983; Garber, Kuroiwa and Gehring, 1983)。在克隆基因组DNA的过程中,这两个实验室都用了Hogness实验室发明的染色体行走方法。1984年,William McGinnis、Michael Levine、Ernest Hafen、Atsushi Kuroiwa和Walter Gehring等五位作者于3月,Mathew Scott和AmyWeiner两位作者于7月分别发表文章,独立发现ANT-C与BX-C编码的mRNA之间有相似的核苷酸序列,而且另外一些基因也含有这一序列(McGinnis et al., 1984a;Scott andWeiner, 1984)。这一核酸序列编码约60个氨基酸(Scott and Weiner, 1984),被称为同源异形盒(homeobox)(McGinnis et al., 1984b)。同源异形盒编码的蛋白质区域称为同源异形域(homeodomain)。Gehring实验室发现果蝇同源异形域的序列与酵母的交配型位点基因a1和a2(MAT a1、a2)相似(Shepherd et al., 1984),而已知这些基因编码的蛋白质在酵母中控制其他基因的转录。Laughon 和Scott(1984)发现果蝇同源异形域还相似于细菌的DNA结合蛋白:l抑制子(l repressor)。而以哈佛大学MarkPtashne为代表的分子生物学家到那时已较多研究过l抑制子,知道它如何结合DNA而调节其他基因的转录,l抑制子当时是基因表达调控的最佳范例(Ptashne,1986)。同源异形域被预计相似于l抑制子的五个a螺旋中的螺旋2和螺旋3,其间一个b转折,亦称螺旋-转-螺旋(helix-turn-helix),而a螺旋3已知为l抑制子识别DNA的部分。以后结构生物学通过X衍射分析同源异形域有一个N端臂(N terminalarm)和三个a螺旋,其中a螺旋3确实与l抑制子的a螺旋3一样嵌入DNA的大沟(major groove)与磷酸和碱基都有作用,而N端臂也与DNA有结合。控制果蝇发育的基因编码的同源异形域含有l抑制子中被证明为结合DNA的序列,自然立即提示同源异形域能结合DNA。旧金山加州大学(UCSF)的Tom Kornberg和Patrick O’Farrell合作克隆到engrailed基因后(Kuner et al., 1985),也发现其cDNA编码的蛋白质含同源异形域(Poole et al., 1985)。O’Farrell实验室的法裔科学家Claude Desplan等实验证明果蝇的同源异形域能结合特异的DNA序列(Desplan et al., 1985),包括engrailed基因本身的上游序列,从而提示可以调节基因表达。而Gehring实验室日本科学家Yasushi Hiromi克隆调节发育的基因fushitarazu(ftz)的上游序列,将此序列于ftz基因编码蛋白质的部分分开,而放到编码细菌lacZ的基因上游,制造融合基因(Hiromi and Gehring,1985): ftz上游-lacZ编码部分。然后通过转基因将此融合基因导入果蝇,发现lacZ基因编码的蛋白质在果蝇胚胎表达的模式与果蝇内源的ftz基因很相像,证明控制发育的基因其非蛋白质编码的上游序列确实能够控制编码蛋白质部分的基因之表达。
发育的分子生物学时代
1980年代中期以后,很多调节果蝇发育的基因纷纷被克隆。基因的功能、基因的表达、基因的调控,呈现了美丽的分子机理。
Lewis认为BX-C含有多个基因,他的工作与后人的分析BX-C突变有9类(abx/bx、bxd/pbx、iab-2、iab-3、iab-4、iab-5、iab-6、iab-7、iab-8,9)。Sanchez-Herrero等(1985)和Tiong等(1985)用发现有三个编码蛋白质的基因(Ubx、abdA、AbdB)。这三个蛋白质都含同源异形域。遗传分析发现,同时缺失这三个基因的表型等同于缺失整个BX-C。BX-C区域DNA完全测序后也证实只有这三个编码蛋白质的基因,其他DNA片段是调节编码蛋白质的基因(Martin et al.,1995; Maeda and Karch,2006)。
Nüsslein-Volhard实验室也从遗传到分子研究了果蝇发育的基因。他们确定bicoid基因是胚胎形成AP轴关键的早期基因,克隆后发现其产物蛋白也含同源异形域。进一步的研究表明,母亲的bicoid基因转录成mRNA后,被运送到受精卵中,积聚于相当于以后胚胎最前段的部位,其指导产生的蛋白质也集中于胚胎最前段,Bicoid蛋白质有限地弥散,在胚胎中产生从前到后的浓度梯度,改变其梯度就能改变AP轴,说明Bicoid蛋白质是典型的形态发生元(morphogen),在不同位置存在于不同浓度决定细胞不同的命运。

![]()
多个实验室克隆了影响AP轴的其他基因后,在分子层面验证了Nüsslein-Volhard和Wieschaus在1980年的设想。首先,很多都是含同源异形域的转录因子,其次原位杂交研究它们在果蝇胚胎的中表达后发现:gap genes在需要其功能的几个连续节段中表达,pair-rule genes在需要其工作的每隔一个节段表达,segmentation polarity基因在其工作的节段内前后特定局部表达。


分子生物学与遗传学优美地互补,在分子水平理解发育的机理:母性效应基因的产物(如Bicoid)在胚胎仅有一个细胞的时候就呈浓度梯度分布,它们少数几个蛋白质确定AP轴,再调节gap 基因的转录,而不同的gap基因相互作用,确定pair-rule基因的转录,后者再确定segment polarity基因的转录。在同一个节段内起作用的segment polarity基因有多种,分别表达在不同排的细胞内。从AP轴的确定到segment polarity基因的表达都是转录调控,但segmentpolarity基因编码不同产物,有些如engrailed是转录因子,有些如wingless(“无翅”)基因和hedgehog(“刺猬”)基因编码分泌型的蛋白质,可以作用于其他细胞。所以,细胞内的转录调控,细胞间的因子引起信号转导,都在发育中起作用,只是果蝇的胚胎因为开始是合胞体,前几步就都用细胞核的转录因子,而细胞成型后也使用细胞间的信号。
除了研究AP轴,Nüsslein-Volhard和Wieschaus的筛选中还发现了影响了背腹轴(DV axis)的基因(Nüsslein-Volhard et al.,1980)。Nüsslein-Volhard实验室的美国博士后Kathryn Anderson等进一步研究和分析了DV轴形成(Anderson and Nüsslein-Volhard, 1984)。他们和其他实验室的一系列研究结果可以总结为:母性效应的几个基因导致相对于胚胎腹侧的母体细胞分泌较多、且加工成熟的Spätzle蛋白质,它激活胚胎细胞膜的Toll受体,触发细胞内Tube蛋白质、激活Pelle蛋白激酶,使Cactus蛋白质脱离Dorsal蛋白质,最终胚胎腹侧的转录因子Dorsal蛋白较多,形成从腹侧到背侧由高而低的浓度梯度,Dorsal蛋白质再通过浓度依赖性调节其他基因的表达,确定腹侧到背侧形成不同的细胞命运。
当然,AP轴和DV轴可以相互作用,最后决定每个细胞的不同身份。在果蝇胚胎只有肠子有左右不对称(left-right axis),所以,LR轴长期未受重视。1990年代以后在蛙胚、鸡胚和鼠胚的研究,推动理解LR轴。三个轴确定胚胎全部体细胞的发育,种系发生细胞,很早与体细胞分开,另外有一套调控的基因,只是其位置受AP轴的影响。三个轴的确定说明动物是按轴坐标系发育,以前曾在有些发育过程提出过可能有极坐标系,迄今适用甚少(Bryant, 1993)。
研究果蝇发育对生物医学研究的推动
果蝇胚胎以合胞体模式开始的发育与脊椎动物有巨大的差别,自然引起疑问:研究果蝇胚胎发育对理解人在内的高等动物有意义吗?
Nüsslein-Volhard和Wieschaus的文章发表后,几年之内上千科学家研究果蝇的基因。对于果蝇前后轴、背腹轴的基因及其产物如何调控发育,有较详尽的研究,发现它们如何分布,如何相互作用,如何形成上下游关系,使一个原本同质的单细胞,逐步变成很多不同身份的细胞,其中理解了细胞身份与其所处位置的关系。
果蝇研究的突破很快推动人们发现果蝇基因在高等动物的同源基因(homologs and orthologs)。同源异形盒发现后,Gehring实验室很快就知道它不限于果蝇,而且存在于包括人在内的其他生物(McGinnis et al., 1984b;Shepherd et al., 1984)。很多实验室研究高等动物含同源异形域的蛋白质,发现进化保守的Hox基因家族,它们分别形成基因复合体,而且在Hox复合体中不同基因的位置与其控制身体位置也有线性相关,提示证明Lewis的工作有很重要的意义,虽然今天还不能说我们已经理解了共线性规律的基本原理。
最初在果蝇中发现控制发育的基因,如同源异形盒的基因,近二十年多来不断发现其相应的人类基因参与疾病。比如一些Hox基因的突变导致外国和中国人群发生多种疾病(如:Muragaki et al.,1996; Mortlock and Innis,1997; Tischfield et al.,2005; Zhao et al.,2007; Webb et al.,2012 ; Lin et al.,2012)。
果蝇研究提示了人工制造器官的可能性。摩尔根实验室很早发现果蝇第四号染色体上eyeless突变,其后果是眼睛很小。当时在Carnegie Institute of Washington的Rubin和Alan Spradling (1982)发现了P转座子,建立了果蝇的转基因技术。1995年,Gerhing实验室通过转基因技术将eyeless基因表达到身体其他部位(如翅膀、腿、触角),发现可以形成异位的眼睛(Halder, Callaerts and Gehring,1995),单个基因如此的开关作用令人感叹。高等动物eyeless基因的同源基因称Pax6,其缺失导致小鼠眼睛减小、人眼睛的虹膜缺失。在原理上,通过Pax6的研究,很大程度修改了以前认为眼睛在演化中出现四十多次而毫无保守机理的想法,认识到虽然完整的眼睛确实多次独立演化而成,但感光结构的前体可能有共同的分子机理。不过在应用上,未能通过单独表达Pax6基因、或几个基因诱导产生高等动物的眼睛,迄今不明能否用这一途径人工制造器官。
对果蝇其他一些发育过程,也有很多研究,其中加州理工的Benzer自1970年代开始发现影响果蝇眼睛发育的基因,1980年代后他实验室和Berkeley加大的Gerald Rubin等实验室推动研究果蝇眼睛发育的基因,证明细胞-细胞相互作用对于细胞命运的重要性,也发现细胞膜蛋白激酶与ras、MAP激酶通路在细胞命运中的作用。而hedgehog(Hh)及其信号转导通路,首先在果蝇发现,并存在于高等动物中。Hh编码分泌型蛋白质,它本身的加工特殊,而Hh的N端部分作用于细胞膜表面受体,激活的信号转导通路,非常见的酶促反应,而包含运动蛋白,提示了一种新型的信号转导模式。
从果蝇的研究很快发现,一些基因并非只起一次作用。比如wingless基因,在果蝇胚胎控制节段内的极性,而在果蝇成虫还起多个作用,其一是调控翅膀发育。
高等动物中果蝇基因的同源基因所起作用不一定相同于果蝇,有时同样的基因,可以起完全不同的作用。比如,参与控制果蝇节段内极性的hedgehog基因,在高等动物有三个同源基因,其中一个对骨发育重要,一个(shh)参与神经管的中线形成、还参与肢体前后轴形成(大拇指和小指是肢体前后轴的表现)。Shh通路的异常与一些脑瘤和很常见的皮肤癌有重要关系,所以科学家试图通过设计影响此通路的药物治疗皮肤癌和脑瘤的方法。这些应用不能从最初研究果蝇的胚胎所推导,而是在果蝇研究突破后,继续在高等动物的很多后续和扩展的研究,影响或推动原本滞后的对高等动物的一些基础和应用研究。
Hogness用染色体行走找果蝇的突变基因,实际开创了位置克隆(positional cloning),多年也是哺乳类(包括人类)遗传学常用的寻找突变/疾病罹患基因的方法。
原来研究果蝇的科学家转行加入拟南芥研究(Meyerowitz and Pruitt, 1985;Yanofsky et al., 1990),带来了果蝇研究的经验、发现拟南芥的同源异形基因,对于拟南芥成为植物生物学的主要模式之一起了重要作用。
果蝇发育的研究,已逾百年,从被人所忽视,到波澜壮阔,出现很多超乎预料的结果,除了直接帮助人们理解果蝇发育的原理和基因,也发现了新的信号转导通路,推论了普适性原理,推动人们发现高等动物发育的基因和原理,提出了控制基因制造人工器官的可能,帮助找到了理解一些人类疾病的基因,发明了从突变找基因的一般性方法。
注:
图1、2、3、6、7为本文之示意图,本文获Nature允许使用发表图4和5,原文为:
Nüsslein-Volhard C and Wieschaus E (1980). Mutations affectingsegment number and polarity in Drosophila. Nature287:795–801.
感谢Yale大学林海凡、许田,Stanford大学骆利群的反馈意见。
文献
Akam ME (1983a). Decoding the Drosophila complexes. TrendsBiochem 8:173-177.
Akam ME (1983b). The location of Ultrabithorax transcripts in Drosophila tissue
sections. EMBO J2:2075–2084.
AndersonKV, Nüsslein-Volhard C (1984). Informationfor the dorsal-ventral pattern of the Drosophila embryo is stored as maternalmRNA. Nature 311: 223–227.
Balkashina EI (1929). Ein Fall der![]() Ein Fall derErbhomoosis (die Genovariation “Aristopedia”) bei Drosophila melanogaster. Archf EntwMech 115:448-463.
Ein Fall derErbhomoosis (die Genovariation “Aristopedia”) bei Drosophila melanogaster. Archf EntwMech 115:448-463.
Bateson WH (1894). Materials for the study of variation, treatedwith especial regard to discontinuity in the origin of species. Macmillan,London.
Braun W (1939). An experimental attack on some problems ofphysiological genetics. Nature144:114-115.
Bender W, Spierer P, and Hogness DS (1983a). Chromosomal walkingand jumping to isolate DNA from the Ace and rosy loci and the bithorax complexin Drosophila melanogaster. J Mol Biol168:17–33.
Bender W, Akam M, Karch F, Beachy PA, Peifer M, Spierer P, LewisEB, Hogness DS (1983b). Molecular genetics of the Bithorax complex inDrosophila melanogaster. Science 221:23–29.
Benzer S (1957). The elementary units of heredity, pp. 70–93 inThe Chemical Basis of Heredity, edited by W. D. McElroy and B. Glass. JohnsHopkins Press, Baltimore
Benzer S (1959). On the topology of the genetic fine structure.Proc. Natl. Acad. Sci. USA 45:1607-1620.
Bridges CB, and Morgan TH (1923). The thirdchromosome group of mutant characters of Drosophila melanogaster. Carnegie Inst. Washington 327:93.
Bridges CB and Dobzhansky Th (1933). The mutant “proboscipedia”in Drosophila melanogaster–a case ofhereditary![]() . Arch f EntwMech127:575-590.
. Arch f EntwMech127:575-590.
Bryant PJ (1993) The polar coordinate model goes molecular. Science 259:471–472.
Crick FHC and Lawrence PA (1975). Compartments and polycones ininsect development. Science189:340-347.
Desplan C, Theis J, O’Farrell PH (1985). The Drosophiladevelopmental gene, engrailed, encodes a sequence-specific DNA bindingactivity. Nature 318:630-635.
Duncan I and Montgomery G (2002a). E. B. Lewis and the bithoraxcomplex. Part I. Genetics160:1265–1272.
Duncan I and Montgomery G (2002b). E. B. Lewis and the bithoraxcomplex. Part II. Genetics 161:1–10.
Garber RL, Kuroiwa A and WJ Gehring WJ (1983).Genomic and cDNA clones of the homeotic locus Antennapedia in Drosophila.EMBO J. 2:2027–2036.
Garcia-Bellido A, Santamaria P (1972). Developmental analysis ofthe wing disc in the mutant engrailed of Drosophila melanogaster. Genetics 72: 87–101.
Garcia-Bellido A (1975). Genetic control of wing discdevelopment in Drosophila, pp. 161–182 in Ciba Found. Symp. 29, CellPatterning.
Garcia-Bellido A, Ripoll P, Morata G (1976). Developmentalcompartmentalization in the dorsal mesothoracic disc of Drosophilamelanogaster. Dev Biol 48: 132–147
Halder G, Callaerts P, and Gehring WJ (1995). Induction ofectopic eyes by targeted expression of the eyeless gene in Drosophila. Science267:1788-1792.
Hiromi Y, Kuroiwa A, Gehring WJ (1985). Control elements of theDrosophila segmentation genefushi tarazu.Cell 43:603-613.
Jacob F and Monod J (1961a). Genetic regulatorymechanisms in the synthesis of proteins. JMol Biol 3:318–356.
Jacob F and Monod J (1961b). On the regulation of geneactivity. Cold Spring Harbor Symp. Quant.Biol. 26:193–211.
Jürgens G, Wieschaus E, Nüsslein-Volhard C, and Kluding H (1984).Mutations affecting the pattern of the larval cuticle in Drosophilamelanogaster II: Zygotic loci on the third chromosome. Wilh. Roux’s Arch. 193:283–295.
Kaufman TC, Lewis R and B Wakimoto (1980). Cytogeneticanalysis of chromosome 3 in Drosophila melanogaster: the homeoticgene complex in polytene interval 84A-B. Genetics94:115–133.
Kuner JM, Nakanishi M, Ali Z, Drees B, Gustavson E, TheisJ, Kauver L, Kornberg T, and O’Farrell PH (1985). Molecular cloning ofengrailed: a gene involved in the development of pattern in Drosophilamelanogaster. Cell 42:309-316.
Laughon A, Scott MP (1984). Sequence of a Drosophila segmentationgene: protein structure homology with DNA-binding proteins. Nature 310:25-31.
Lewis EB (1951). Pseudoallelism and gene evolution. Cold Spring Harbor Symp. Quant. Biol.16: 159–174.
Lewis EB (1955). Some aspects of position pseudoallelism. Amer Nat 89:73-89.
Lewis EB (1963). Genes and developmental pathways. Am Zool 3:33–56.
Lewis EB (1964). Genetic control and regulation ofdevelopmental pathways, pp. 231–252 in Role of Chromosomes in Development,edited by M. Locke. Academic Press, New York.
Lewis EB, and Bacher F (1968). Methods offeeding ethylmethane sulfonate (EMS) to Drosophilamales. Dros. Inf. Serv. 43:193.
Lewis EB (1978). A gene complex controlling segmentationin Drosophila. Nature 276:565–570.
Lin Z, Chen Q, Shi L, Lee M, Giehl KA, Tang Z, Wang H, Zhang J,Yin J, Wu L, Xiao R, Liu X, Dai L, ZhuX, Li R, Betz RC, Zhang X, Yang Y (2012). Loss-of-function Mutations in HOXC13 CausePure Hair and Nail Ectodermal Dysplasia. AmJ Hum Genet 91:906-11.
Maeda RK and Karch F (2006). TheABC of the BX-C: the bithorax complex explained. Development 133:1314-1422.
Maniatis T, Hardison RC, Lacy E,Lauer J, O’Connell C, Quon D,Sim GK, Efstratiadis A (1978). The isolation of structural genes from librariesof eucaryotic DNA. Cell 15:687-701.
Martin CH, Mayeda CA, Davis CA, Ericsson CL, Knafels JD, MathogD R, Celniker SE, Lewis EB and Palazzolo MJ (1995). Complete sequence of thebithorax complex of Drosophila. Proc.Natl. Acad. Sci. USA 92, 8398-8402.
McGinnis, W., M. Levine, E. Hafen, A.Kuroiwa and W. J. Gehring (1984a). A conserved DNA sequence in homeotic genesof the Drosophila Antennapedia and bithorax complexes. Nature 308:428–433.
McGinnis W, Garber R, Wirz J, Kuroiwa A andGehring WJ (1984b). A homologous protein-coding sequence in Drosophila homeoticgenes and its conservation in other metazoans. Cell 37:403–408.
Meyerowitz EM and Pruitt RE (1985). Arabidopsis thaliana and plant moleculargenetics. Science229:1214-1218.
Mortlock DP, Innis JW (1997). Mutation of HOXA13 inhand-foot-genital syndrome. Nat. Genet.15:179-180.
Muragaki Y, Mundlos S, Upton J, Olsen BR (1996). Altered growthand branching patterns in synpolydactyly caused by mutations in HOXD13. Science 272:548-551.
Nüsslein-Volhard C and Wieschaus E (1980). Mutations affectingsegment number and polarity in Drosophila. Nature287:795–801.
Nüsslein-Volhard C, Lohs-Schardin M, Sander K, Cremer C (1980).A dorso-ventral shift of embryonic primordia in a new maternal-effect mutant ofDrosophila. Nature 283:474–6.
Nüsslein-Volhard C, Wieschaus E, and Kluding H (1984). Mutationsaffecting the pattern of the larval cuticle in Drosophila melanogaster I:Zygotic loci on the second chromosome. Wilh.Roux’s Arch. 193:267–282.
Poole SJ, Kauvar LM, Drees B, Kornberg T (1985). The engrailedlocus of Drosophila: structural analysis of an embryonic transcript. Cell 40:37-43.
Postlethwait JH, Schneiderman HA (1969). A clonal analysis ofdetermination in Antennapedia a homoeotic mutant of Drosophila melanogaster. Proc Natl Acad Sci 64:176-83.
Postlethwait JH, Schneiderman HA (1971). Pattern formation anddetermination in the antenna of the homoeotic mutant Antennapedia of Drosophilamelanogaster. Dev Biol 25:606–640.
Poulson DF (1937). Chromosomal deficiencies and the embryonicdevelopment of Drosophila Melanogaster. Proc.Natl. Acad. Sci. 23:133-137.
Poulson DF (1940). The effects of certain X-chromosomedeficiencies on the embryonic development of Drosophila melanogaster. J. Exp. Zool. 83:271–335.
Poulson DF (1950). Histogenesis, organogenesis, anddifferentiation in the embryo of Drosophila melanogaster meigen, pp. 168–274 inDemerec M ed, Biology of Drosophila, John Wiley and Sons.
Ptashne M (1986). A genetic switch: gene control and phagelambda. Blackwell, Boston.
Rubin GM, Spradling AC (1982). Genetic transformation ofDrosophila with transposable element vectors. Science 218:348-53.
Sanchez-Herrero E, Vernos I, Marco R and Morata G (1985).Genetic organization of Drosophila bithorax complex. Nature 313, 108-113.
Scott, M. P., A. J. Weiner, T. Hazelrigg, B. A. Polisky,V. Pirrotta, Scalenghe F, Kaufman TC (1983). The molecular organization of theAntennapedia locus of Drosophila. Cell35:763–776.
Scott, MP, and AJ Weiner (1984). Structuralrelationships among genes that control development: sequence homology betweenthe Antennapedia, Ultrabithorax, and fushi tarazu loci of Drosophila.Proc. Natl. Acad. Sci. USA 81:4115–4119.
Shepherd JCW, McGinnis W, Carrasco AE, DeRobertis EM, Gehring WJ(1984). Fly and frog homoeo domain show homologies with yeast mating typeregulator proteins. Nature 310:70–71.
Tiong S, Bone LM and Whittle JR (1985). Recessive lethalmutations within the bithorax-complex in Drosophila. Mol Gen Genet 200:335-342.
Tischfield MA, Bosley TM, Salih MA, Alorainy IA, Sener EC,Nester MJ, Oystreck DT, Chan WM, Andrews C, Erickson RP et al. (2005).Homozygous HOXA1 mutations disrupt human brainstem, inner ear, cardiovascularand cognitive development. Nat. Genet.37:1035-1037.
Webb BD, Shaaban S, Gaspar H, Cunha LF, Schubert CR, Hao K,Robson CD, Chan WM, Andrews C, Mackinnon S, et al. (2012). HOXB1 FounderMutation in Humans Recapitulates the Phenotype of Hoxb1(-/-) Mice. Am. J. Hum. Genet. 91:171-179.
Wensink PC, Finnegan DJ, Donaldson JE, Hogness DS (1974). Asystem for mapping DNA sequences in the chromosomes of Drosophila melanogaster.Cell 3:315-325.
Wieschaus E, Nüsslein-Volhard C, and Jürgens G (1984) Mutationsaffecting the pattern of the larval cuticle in Drosophila melanogaster III:Zygotic loci on the X-chromosome and fourth chromosome. Wilh. Roux’s Arch. 193:296–308.
Yanofsky MF, Ma H, Bowman JL, Drews GN, Feldmann KA, MeyerowitzEM (1990). The protein encoded by the Arabidopsis homeotic gene agamousresembles transcription factors. Nature346:35-39.
Zhao X, Sun M, Zhao J, Leyva JA, Zhu H, Yang W, Zeng X, Ao Y,Liu Q, Liu G, et al. (2007). Mutations in HOXD13 underlie syndactyly type V anda novel brachydactyly-syndactyly syndrome. Am.J. Hum. Genet. 80:361-371.
2013年发表于《中国科学生命科学》
Rao Y(2013) Genetic control of development: the discovery of homeobox. Scientia Sinica Vitae 43, doi:10.1360/052013-180
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29








