《Autophaghy》杂志揭示AD发病新机制-MAPT/Tau聚集与自噬
《Autophaghy》揭示阿尔兹海默症AD发病新机制-MAPT/Tau聚集&自噬
阿尔兹海默症(Alzheimer‘s disease,AD)发病机制复杂,细胞内MAPT/Tau蛋白的异常聚集形成的神经元纤维缠结是AD典型的病理学特征。过去研究表明自噬障碍造成MAPT聚集,但MAPT聚集反过了对自噬有何影响尚不清楚。
2019年6月28日,华中科技大学同济医学院在国际权威期刊《Autophagy》(影响因子11.1)发表了题为“MAPT/Tau accumulation represses autophagy flux by disrupting IST1-regulated ESCRT-III complex formation: a vicious cycle in Alzheimer neurodegeneration”的文章。
详细阐述了MAPT/Tau聚集通过扰乱IST1调节的ESCRT-III复合物的形成而抑制自噬,而自噬障碍又加重MAPT蛋白聚集的恶性循环机制,揭示了AD发病机制的深入研究提供新的依据。

为验证MAPT对于自噬的影响,作者在HEK293细胞系瞬时或稳定过表达人全长MAPT蛋白,发现自噬标志物LC3-II和SQSTM1/P62蛋白水平升高(图1A-C,F-I),
同时作者使用了吉凯基因提供的慢病毒Lenti-RFP-LC3与AAV-MAPT共感染培养原代海马神经元,观察到MAPT聚集能够引起LC3阳性囊泡数量增加(图1D)。自噬流检测以及免疫电镜的结果亦显示MAPT蛋白聚集可诱导自噬障碍。
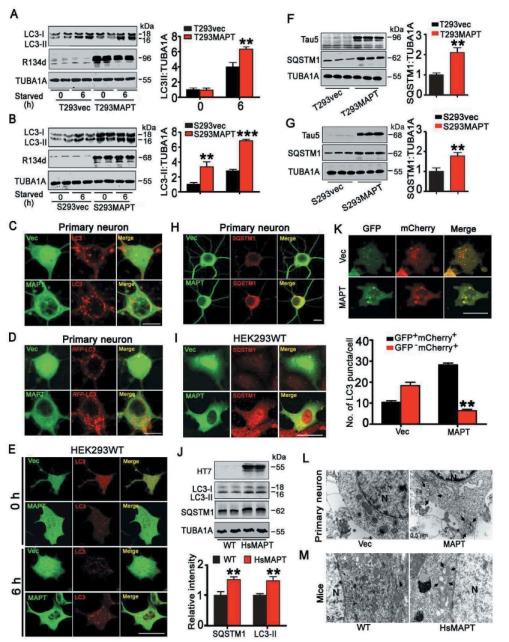
图1过表达人源MAPT通过自噬体聚集诱导自噬障碍
那么MAPT是通过什么机制影响自噬降解过程的呢?
作者通过mRNA芯片检测发现正向调节内涵体分选复合物ESCRT形成的基因IST1(与ESCRT-III相关的IST1因子)mRNA水平降低,并在MAPT过表达细胞系、hsMAPT转基因鼠动物模型及AD病人脑组织切片中证实了IST1蛋白水平的下降(图2)。提示IST1可能参与了ESCRT相关的自噬信号通路
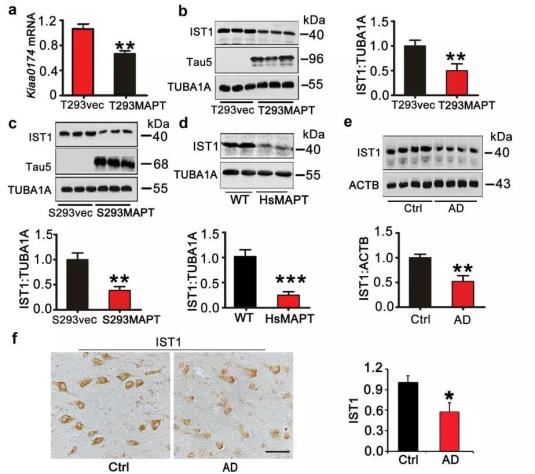
图2.HsMAPT过表达引起IST1mRNA以及蛋白水平下调
接着作者推测IST1的下调可能在MAPT引起的自噬障碍中起到了一定作用,为了验证这一猜想,首先在野生型HEK293细胞、原代海马神经元和C57小鼠海马CA3区域下调IST1的表达,发现下调IST1可诱导自噬体的聚集和自噬标志物LC3-II和SQSTM1/P62蛋白水平升高(图3);
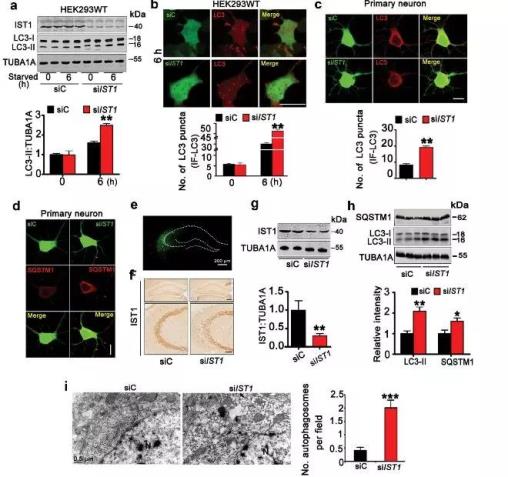
图3.下调IST1诱导自噬体聚集
同时在稳转MAPT的HEK293细胞和hsMAPT转基因鼠上调IST1,发现上调IST1可促进自噬体和溶酶体的融合从而逆转自噬障碍(图4)。
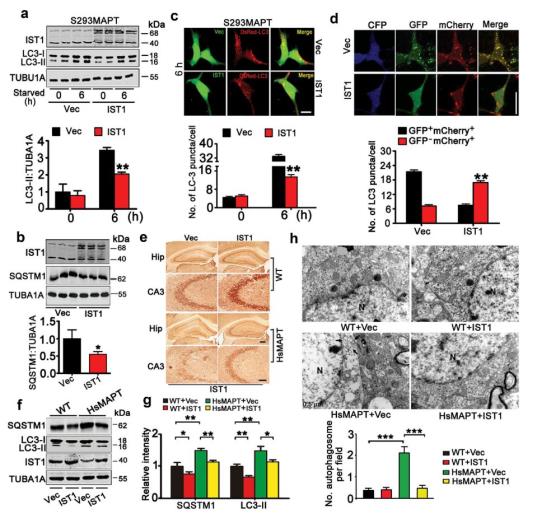
图4.上调IST1通过促进自噬体和溶酶体的融合逆转自噬障碍
在体实验中,作者通过水迷宫实验发现过表达IST1能够逆转HsMAPT转基因鼠行为学异常(图5C&D);而下调IST1的表达,可诱导动物学习记忆能力障碍,提示IST1在空间学习和记忆中发挥重要作用(图5G-H)。
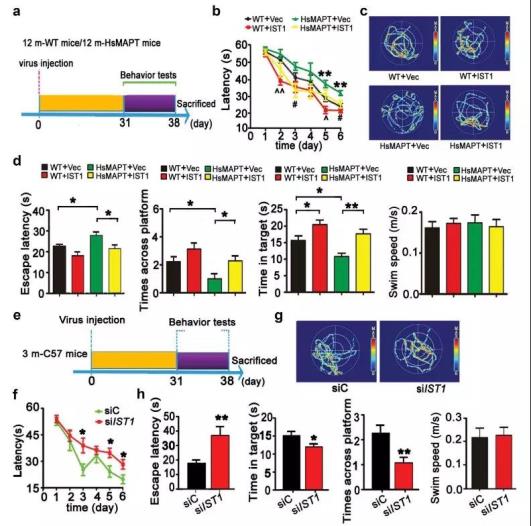
图5.上调IST1能够改善HsMAPT转基因小鼠的认知障碍
同时通过脑片电生理fEPSC记录、树突棘密度结合Western blot分别测定可溶性和不可溶性MAPT的方法发现IST1能够可通过增强突触可塑性和促进不可溶性MAPT蛋白降解(去磷酸化)改善转基因鼠的认知障碍(图6)。
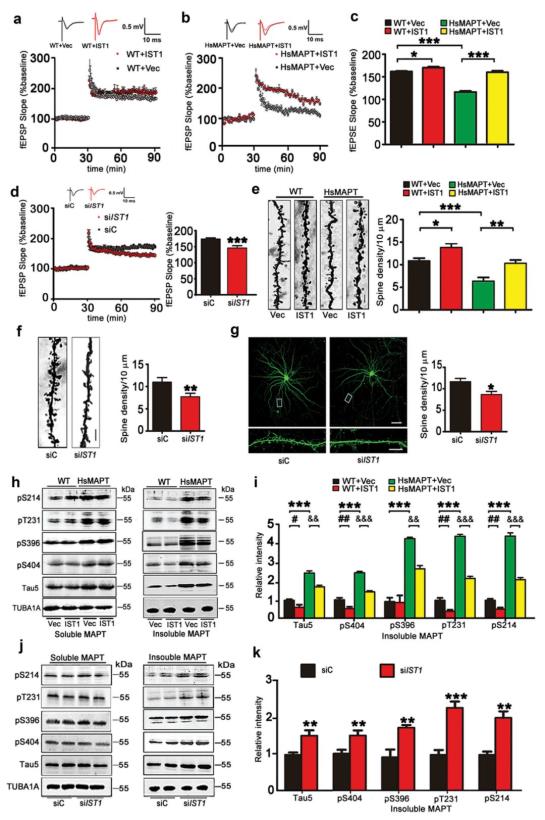
图6.IST1调节突触可塑性以及MAPT降解
作者进一步研究IST1蛋白水平降低导致自噬障碍的机制,发现IST1蛋白水平降低可导致其与CHMP2B和CHMP4B/SNF-2(ESCRT-III的两个重要组成成分)的相互结合减少,从而妨碍ESCRT-III复合物的形成,导致自噬障碍(图7)。
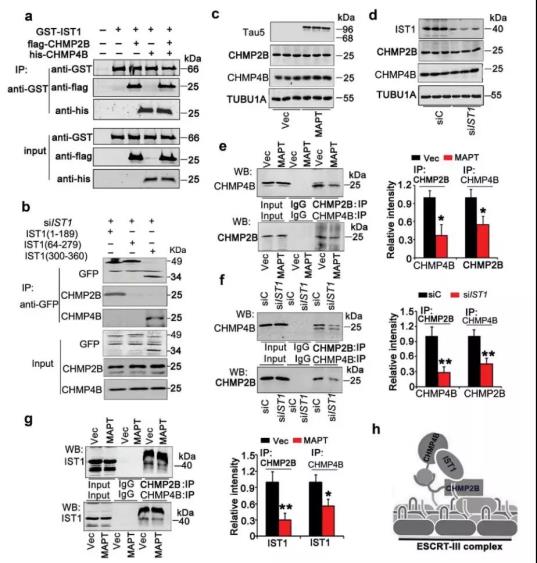
图7.IST1下调抑制ESCRT-III复合物形成
最后作者对MAPT聚集抑制IST1表达的机制进行了探究,利用吉凯基因提供的慢病毒Leiti-siANP32A-RFP敲低HsMAPT转基因小鼠海马神经元的ANP32A,能够显著降低AcH4K12以及IST1的表达水平,证明MAPT蛋白聚集能够使通过上调ANP32A所介导的组蛋白去乙酰化而抑制IST1的表达(图8. e,f)。
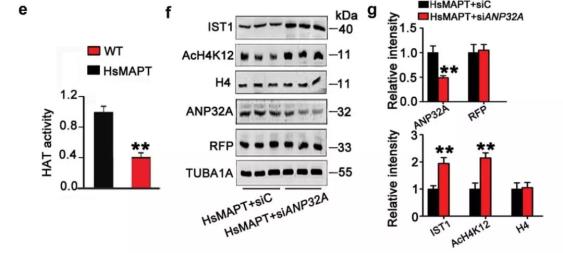
图8.MAPT通过组蛋白乙酰化抑制IST1的转录
总结
MAPT蛋白聚集通过CEBPB-ANP32A-INHAT通路抑制IST1的表达,从而妨碍ESCRT-III复合物的形成,抑制自噬体和溶酶体的融合,导致自噬障碍;而自噬障碍则进一步加重MAPT蛋白聚集。
这样在MAPT蛋白聚集和自噬障碍之间就形成一个恶性循环,最终使突触可塑性下降,学习记忆能力损伤。这一研究结果揭示了AD新的发病机制,提示IST1可作为AD药物研发的新分子靶标。
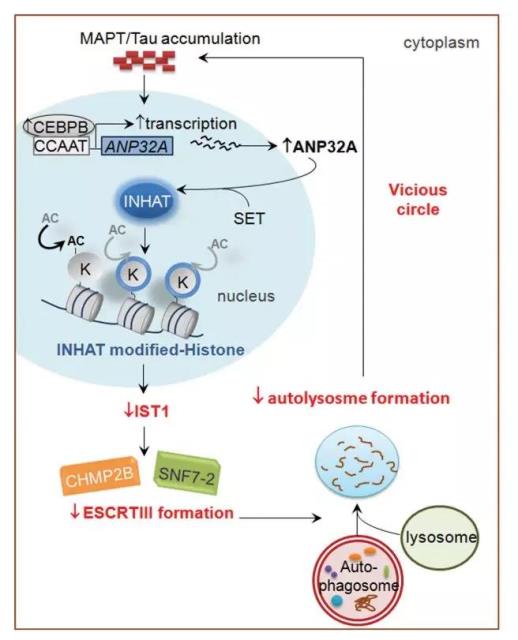
图9. MAPT聚集与自噬障碍的恶性循环作用机制图
该研究中慢病毒产品:Lenti-CMV-RFP-LC3以及Lenti-CMV-RFP-siANP32A及对照病毒由吉凯基因提供。Lenti-CMV-RFP-LC3通过感染原代培养的海马神经元,能够直观地看到MAPT聚集对LC3自噬囊泡产生的影响(图10左)。
Lenti-CMV-RFP-siANP32A高效感染HsMAPT转基因小鼠海马CA3脑区实现ANP32A的敲低,观察其对组蛋白乙酰化相关蛋白以及IST1蛋白表达的影响。
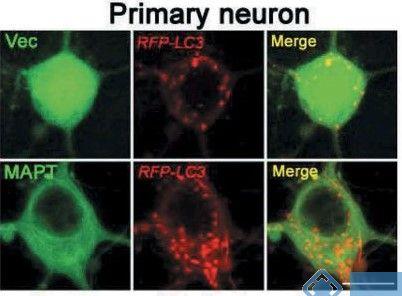
图10. 吉凯基因病毒感染效果
来源: 上海吉凯基因医学科技股份有限公司
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
-
- 2021-03-31
- 2020-07-31
- 2019-09-16
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29
- 2019-08-29








